葉子,是植物行光合作用的主要地方,所製造出的產物除了提供植物本身生長所需,它的次級產物:氧氣,更是地球上生物體生存不可或缺的重要元素。而在植物葉子的組織中,表皮是植物體與外界接觸的第一道防線,經過一連串的環境適應演化,發展出形狀特殊且功能不同的細胞,具有保護葉片內部組織、調節水分和氣體交換的功能,使植物具有防禦和適應環境的能力。其中常見的細胞有三大類(圖一):一、葉片上的毛狀突起物(trichome):於物理結構上,它可避免昆蟲的叮咬,有些則可散發出揮發性化學物質而防止昆蟲靠近。二、氣孔(stomata):構造像植物的嘴巴,由一對保衛細胞所構成,控制著氣體(如二氧化碳和氧氣)和水蒸氣的進出;氣孔的開合受到植物內外環境因素的調控,例如光照、濕度和二氧化碳濃度等。三、表皮細胞(pavement cell):這些細胞通常緊密相連,形成一個連續的層狀結構。有趣的是,在雙子葉植物中,它的形狀就如同拼圖般,緊緊相扣。表皮細胞與空氣接觸的部份通常被一層稱為角質層(cuticle)的蠟質所包覆,這有助於減少水分的蒸發。
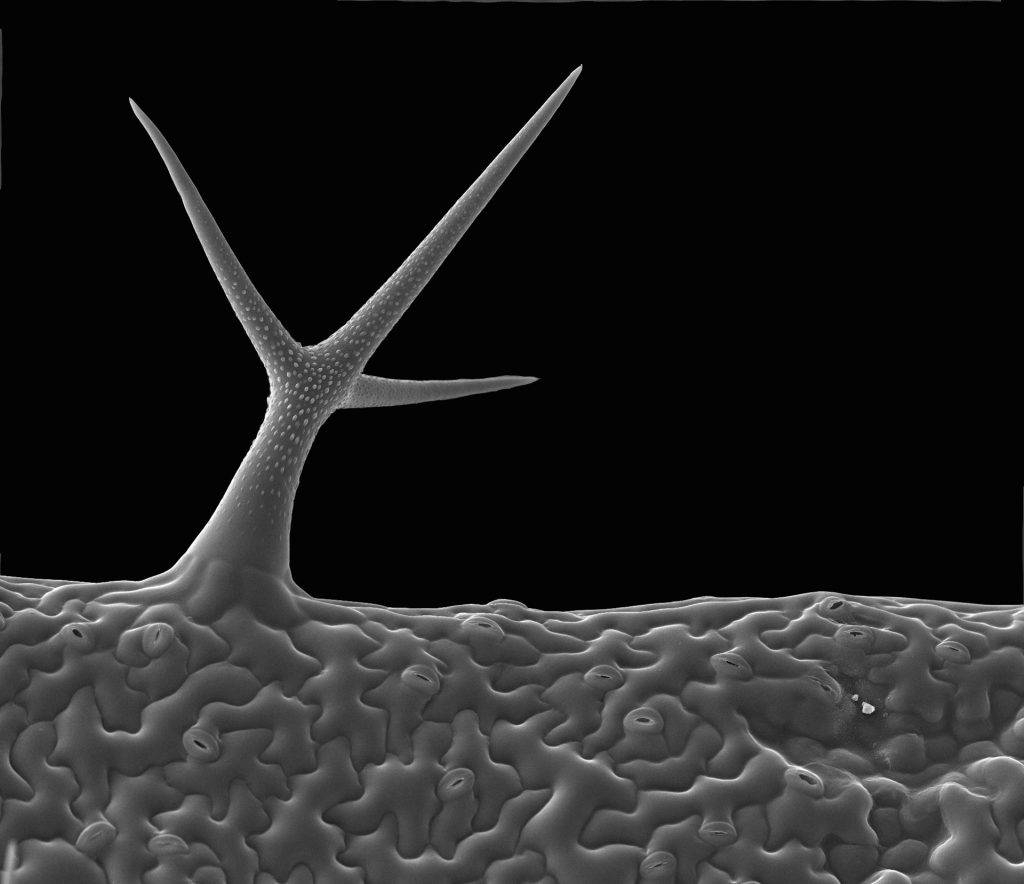
▲圖一 葉表皮組織有如同樹 枝狀毛狀突起物(trichome),嘴巴狀之氣孔(stomata)以及拼圖狀之表皮細胞(pavement cell),協同防禦及調控水分散失。
圖片:植微所簡萬能研究技師。
然而在演化上,氣孔一開始的功能並不是作為氣體交換的,而是位於苔蘚植物的孢子體表面上,幫助孢子囊排水乾燥、破裂而釋放出孢子的重要結構 1。但慢慢地,植物脫離水生環境,氣孔就演變成二氧化碳進入植物體內的重要通道。當氣孔打開時,空氣中的二氧化碳便會進入葉片中,成為光合作用的原料,同時,水分也會蒸散出去,降低植物本身的溫度。但如何達到最高的水分使用效率,即有最大的二氧化碳輸入,又不散失過多的水分,在當今氣候變遷造成的乾旱環境下顯得格外的重要。雖然說是植物的嘴巴,氣孔的反應其實是很慢的,依不同植物可有數分鐘到數十分鐘之久。而環境的變化是瞬息萬變,為了使植物的反應變快,植物生理學家利用改變保衛細胞內的離子通道讓氣孔的開合變得更為靈敏,不僅提升了水分使用效率,又不影響光合作用的固碳能力及植物的產量 2。另一方面,植物發育學家則利用已知的氣孔發育模式,在稻米葉片上減少了一半的氣孔數量,此做法降低水分的散失,但同時也不影響作物的產量 3。
氣孔通常是一顆顆散佈在葉表皮上,且兩兩互不相接觸(圖二) 。雙子葉植物的氣孔為腎臟型,而單子葉植物則為啞鈴型,因為單子葉植物的氣孔旁多了一對輔助細胞,它的功能為幫助氣孔開合更有效率 4。有趣的是,輔助細胞和氣孔的保衛細胞並不是來自同一個母細胞,輔助細胞是由旁邊的細胞分裂而來的。除了常見的單一氣孔排列,「簇狀」氣孔已在開花植物的六十五個屬中被報導過,例如秋海棠。減少氣孔的數量除了可減少水分散失外,數學模型也支持簇狀構造可減少水分蒸散作用 5。研究發現乾旱及高鹽度都可能造成簇狀氣孔的生成 6,然而,聚集氣孔的演化起源以及表型變化是否與環境適應相關,在很大程度上還未被探索。
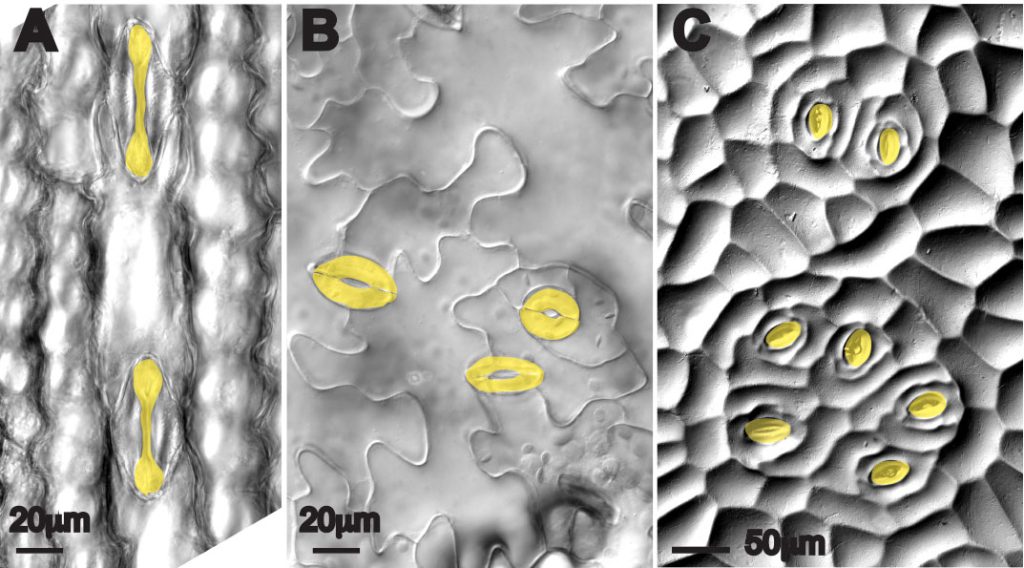
▲圖二 氣孔表型因物種而異:(A)水稻中的啞鈴形氣孔(黃色);(B)擬南芥中的腎形氣孔;(C)Begonia hernandioides 中的簇狀氣孔。
為了了解群聚型氣孔是否能增加了陸生植物在乾旱環境中的生存優勢,我們利用兩種亞洲秋海棠,Begonia formosana(單一型氣孔)和 B. hernandioides(群聚氣孔型)來探索植物的水份使用能力及群聚型氣孔的發育機制 7。研究發現在高光強度下,B. hernandioides 表現出更高的水分利用效率,氣孔開合程度較小,開孔速度較快。分析群聚型氣孔之間的距離發現,群聚型氣孔可以促進細胞間的交互作用,以實現氣孔運動的同步性。另外,研究抑制氣孔發育相關基因 TMM(too many mouths),也發現 B. hernandioides 的 TMM 功能比較低弱,可能為群聚型氣孔發生的原因。秋海棠氣孔聚集可能是一種生存策略,亦即建立更小更近的氣孔以加速對光的反應,減少水份散失。
在植物陸生化的過程中,角質的生成及氣孔的產生皆為植物防止及調節水份散失的重要特徵。然而此二者在發育上是否有相關並不清楚。在一份 1972 年的研究曾經提及一種大麥的突變體擁有較少的角質層且有氣孔群聚的現象,但潛在的發育機制及此二者又是如何互相調控,都未曾被探討過。我們利用分子生物學的研究方式找出了調控葉表皮角質生成的基因,並發現在葉子發育的早期,氣孔的原始細胞必須抑制角質的合成,即這時的細胞必須夠柔軟以維持表皮層的適當結構和生物力學,以形成適當的氣孔排列 8。這說明了除了生物化學信號之外,表皮的物理性張力也會影響組織的生長與發育,而拼圖狀葉表皮細胞的形成也是其中一個例子。利用模擬的方式推論表皮細胞長大與葉片生長方向的相互妥協下,細胞兩兩鑲嵌可形成最穩定結構的結果 9;此發現可驗證兩百年前植物學家所提出的重要發育假說:表皮為決定組織大小的重要因素(epidermal growth control theory, 1867) 10。
植物不會移動,為了適應各種環境,它們只能靠著重塑自我的發育而得以生存與繁衍後代。例如,葉表皮細胞具有高度可塑性,它們能夠重塑發育過程以產生不同的表皮細胞組成與結構來因應環境變化,因此觀察不同時期的植物標本時,應可看出植物表皮細胞因應當下地球環境所產生的發育變化。一份 1987 年的研究指出,十八世紀工業革命前大氣二氧化碳含量為 280 ppm ,而當時為 340 ppm,兩百年間,植物氣孔的密度(單位面積下的數量)下降了 40% 11,由此可見,氣孔發育是具有可塑性的。
在葉表皮細胞中,我們把此種具選擇增生或分化成特定功能的細胞稱之為幹細胞,然而葉表皮幹細胞的全能性(multipotency)是如何維持的?幹細胞又是如何決定要繼續分裂或是分化?仍存在許多未知。因此我們利用植物葉表皮的幹細胞(SLGCs, stomatal lineage ground cells)來探討葉表皮幹細胞的全能性,研究發現具分裂能力的葉表皮幹細胞能藉由調控細胞週期決定其增生或是分化 12。當今的大氣二氧化碳含量約為 411 ppm,加上極端氣候的影響,如何使作物生長得更好是當代科學家共同致力的目標。利用對於葉表皮幹細胞的了解,將可應用於改善植物的生長及生產力,以突破氣候變遷對糧食作物生長與植物生態帶來的不利影響。
- Chater, C. C. et al. Origin and function of stomata in the moss Physcomitrella patens. Nature Plants 2, 16179 (2016). https://doi.org:10.1038/nplants.2016.179
- Papanatsiou, M. et al. Optogenetic manipulation of stomatal kinetics improves carbon assimilation, water use, and growth. Science 363, 1456 (2019). https://doi.org:10.1126/science.aaw0046
- Caine, R. S. et al. Rice with reduced stomatal density conserves water and has improved drought tolerance under future climate conditions. The New phytologist (2018). https://doi.org:10.1111/nph.15344
- Raissig, M. T. et al. Mobile MUTE specifies subsidiary cells to build physiologically improved grass stomata. Science 355, 1215-1218 (2017). https://doi.org:10.1126/science.aal3254
- Lehmann, P. & Or, D. Effects of stomata clustering on leaf gas exchange. New Phytologist 207, 1015-1025 (2015). https://doi.org:10.1111/nph.13442
- Gan, Y. et al. Stomatal clustering, a new marker for environmental perception and adaptation in terrestrial plants. Botanical Studies 51, 325-336 (2010).
- Tsai, M.-Y. et al. Stomatal clustering in Begonia improves water use efficiency by modulating stomatal movement and leaf structure. Plant-Environment Interactions 00, 1-14 (2022). https://doi.org:https://doi.org/10.1002/pei3.10086
- Yang, S. L., Tran, N., Tsai, M. Y. & Ho, C. K. Misregulation of MYB16 expression causes stomatal cluster formation by disrupting polarity during asymmetric cell divisions. The Plant cell 34, 455-476 (2022). https://doi.org:10.1093/plcell/koab260
- Sapala, A. et al. Why plants make puzzle cells, and how their shape emerges. eLife 7, e32794 (2018). https://doi.org:10.7554/eLife.32794
- Kutschera, U. & Nikas, K. J. The epidermal-growth-control theory of stem elongation: An old and a new perspective. Journal of Plant Physiology 164, 1395-1409 (2007). https://doi.org:10.1016/j.jplph.2007.08.002
- Woodward, F. I. Stomatal numbers are sensitive to increases in CO2 from pre-industrial levels. Nature 327, 617 (1987). https://doi.org:10.1038/327617a0
- Ho, C.-M. K., Bringmann, M., Oshima, Y., Mitsuda, N. & Bergmann, D. C. Transcriptional profiling reveals signatures of latent developmental potential in Arabidopsis stomatal lineage ground cells. Proceedings of the National Academy of Sciences 118, e2021682118 (2021). https://doi.org:10.1073/pnas.2021682118
