自開天闢地以來,人類經歷不同時期生活型態的轉換,無論是狩獵採集、農業生活,面對無所不在的病菌且醫藥尚未發展之時,是什麼契機讓人類存活繁衍,而不至於滅絕?
這可以從各個學門進行討論,對於科學家而言,「免疫系統」是其中一個解釋。人體最廣泛的免疫系統是皮膚,最先抵禦外在病原菌的直接接觸;除此之外,我們可能也會把呼吸道病原菌吸進肺裡,造成常見的呼吸道症狀、支氣管炎或肺炎,鼻毛做為第一層抵禦的屏障,可以過濾病原菌與髒汙;呼吸道中圓柱型的上皮細胞也演化成具有纖毛的構造,掃除呼吸道中的大小顆粒;尚未被掃地出門的呼吸道病原菌,便會伺機的感染上皮細胞,另人聞之色變的新型冠狀病毒主要便是藉由口、鼻進入呼吸系統並且搜尋具有 ACE2 受體的細胞,像是呼吸道上皮細胞,進行感染。
病毒進入細胞後,便肆無忌憚的拆解各個部位,藉由自身攜帶的 RNA 依賴 RNA 聚合酶(RNA dependent RNA polymerase)進行本體 RNA 基因複製,與病毒蛋白質的轉錄與轉譯,鳩佔鵲巢的利用宿主細胞的胞器進行病毒蛋白質的修飾。最終,成千上萬組裝完善的病毒顆粒由宿主細胞破繭而出,再度感染周遭的細胞。
宿主細胞的反撲:先天性與適應性免疫反應
受感染之細胞藉由 TLR (Toll like receptor)辨識到了病毒 RNA,因而誘發一系列之訊號傳遞,觸發干擾素(IFN, interferon)與其他細胞激素,例如:TNF-α、IL-6 與 IL-18 的釋放,來抵禦病毒的感染;另一方面細胞激素也可能是由樹突細胞、巨噬細胞等這些衛兵細胞吞噬病毒後所釋放。這些反應屬於「先天性免疫反應」的範疇。面對來勢兇猛的病毒,先天性免疫反應來得又急又快,但缺乏特異性與記憶性,無法提供長久的保護。先天性免疫的衛兵細胞吞噬病毒後,會呈現病毒的片段直接或間接的活化 T 細胞,活化的 TC 細胞會撲殺呈現病毒片段(抗原)的細胞;另一方面,活化的 TH 細胞,則會誘發 B 細胞進化為漿細胞產生特異性抗體。而 B 細胞是具有記憶性的,面對相似的外來者,B 細胞可迅速的反應生產對抗新型冠狀病毒表面棘蛋白抗體,阻擋病毒與 ACE 受體的辨識或與先天性免疫細胞聯合撲殺病原菌。
先天與後天免疫系統完美的搭配,保護了人類抵禦了許多病原菌感染,使人類不是那麼的不堪一擊。而「疫苗」,則由人為的方式製作成免疫原,使人體預先辨識病原菌表面蛋白質因而產生特異性抗體,預防即將到來的病原菌感染。
新型冠狀病毒的求生欲
對於所有物種來說,繁衍都是件重要的事,病毒也不例外。讓宿主細胞不斷的為自己進行複製後,新型冠狀病毒藉由飛沫的方式,在各個宿主間傳播,同時跟著現代化運輸一起周遊列國,傳播的能力可能比無遠弗屆的網路更勝一籌。
人類針對新型冠狀病毒研發疫苗與中和性抗體,以病毒表面分布的棘蛋白或主要和 ACE2 受體結合的 RBD 為標的進行設計。疫苗誘導的抗體與治療性抗體,大多是用來阻斷病毒與宿主細胞 ACE2 的結合,抑制病毒進入細胞,這些抗體也稱之為「中和性抗體」。中和性抗體可以降低病毒在體內複製的數量,因而避免疾病惡化、加速病毒在體內的清除使患者康復。
但新型冠狀病毒如何避開這些中和性抗體的結合呢?首先我們得先談談新型冠狀病毒的突變率。新型冠狀病毒攜帶 RNA 依賴性 RNA 聚合酶,作為複製病毒 RNA 基因體與轉錄、轉譯病毒蛋白質;RNA 聚合酶擁有比 DNA 聚合酶較高的突變率,因此,RNA 病毒相較 DNA 病毒,先天上就比較容易突變。新型冠狀病毒因為感染宿主數眾多,再搭配 RNA 聚合酶的突變率,造成從 2019 年底開始從武漢病毒株,不斷有新變異株產生,包含:2021 年流行的 Alpha、Beta、Gamma、Delta,以及 2021 年底急速成長的 Omicron,Omicron 也不斷的有小變異,使得 Omicron 系列的亞變異株在 2022 年於各國遍地開花。
抗體的應用:抗體藥物
單株抗體藥物早已廣泛應用於人類疾病的治療,針對新型冠狀病毒,Bamlanivimab 和 REGEN-COV(Casirivimab + Imdevimab)在 2020 年 11 月獲得美國食品藥物管理局(FDA)的緊急使用授權(EUA)後,即投入新型冠狀病毒的治療,至今共有 8 株抗體獲得美國 FDA EUA,美國政府共採購超過 550 萬劑,對於治療新型冠狀病毒和拯救生命有卓越的貢獻。在後疫情時代,新型冠狀病毒的疫苗有高比例的接種率,以及小分子病毒藥物上市,對於治療性抗體的發展有劇烈的影響。然而根據研究報導,美國約有 700 萬人,英國約有 50 萬人被認為免疫功能低下,因此對新型冠狀病毒疫苗的免疫反應較低,誘導產生的抗體效價不足,可能容易造成突破性感染。治療性抗體於體內長效的半衰期有機會彌補此缺口,擔任預防的角色,例如:REGEN-COV 和 Evusheld (Cilgavimab + Tixagevimab)用於預防中重症的保護效果分別有 81% 和 83%,因此美國 FDA 給予用於預防的 EUA。 Omicron BA.5 變異株在 2022 年成為世界主要流行株,因在棘蛋白高度的突變,使得許多 EUA 核可使用之治療性抗體失去針對 Omicron 的中和能力(IC50 >10 μ g/mL)。因此美國 FDA 更因此於 2022 上半年,暫停使用 4 款 EUA 之治療性抗體。顯示,研發廣效性且能中和當前變異株之治療性抗體是重要的醫療需求。
本院生醫轉譯研究中心吳漢忠主任實驗室團隊利用脂質奈米粒子(LNP)包覆新型冠狀病毒棘蛋白的 mRNA 與小鼠融合瘤技術,來製備對抗新型冠狀病毒 RBD 的單株抗體。此 LNP-mRNA 技術可以節省傳統重組蛋白抗原製作生產的時間,並且更適用於困難生產的抗原蛋白,例如:膜蛋白、大分子量、高疏水性蛋白等,篩選出 5 株可以辨認 Omicron RBD 的單株抗體,並以偽慢病毒證實其可廣泛性地中和新型冠狀病毒變異株,包含:Alpha、Beta、Gamma、Kappa、Delta、Omicron、BA.1 與 BA.2。
實驗團隊進一步將其中兩株運用抗體工程技術進行抗體人源化,測試後,成功地延續對 BA.2 偽慢病毒的良好抑制能力(圖一上)。另一方面使用人類單一 B 細胞抗體技術,從接種疫苗或是感染痊癒後捐贈者的血液分離特定變異株的中和性抗體(圖一下)。實驗團隊篩選出對一系列對 Omicron 亞變異株的中和性抗體,包含 BA.1、BA.2、BA.4/5、BQ.1.1、BF.7、和 XBB.1。在 2023 年初,Omicron BQ 已超越 BA.5 成為全球的流行變異株。BQ 跟 BA.5 相比,在 RBD 上多了 K444T 與 M406K 兩個突變為點,成功逃脫了 Bebtelovimab 治療性抗體的結合。
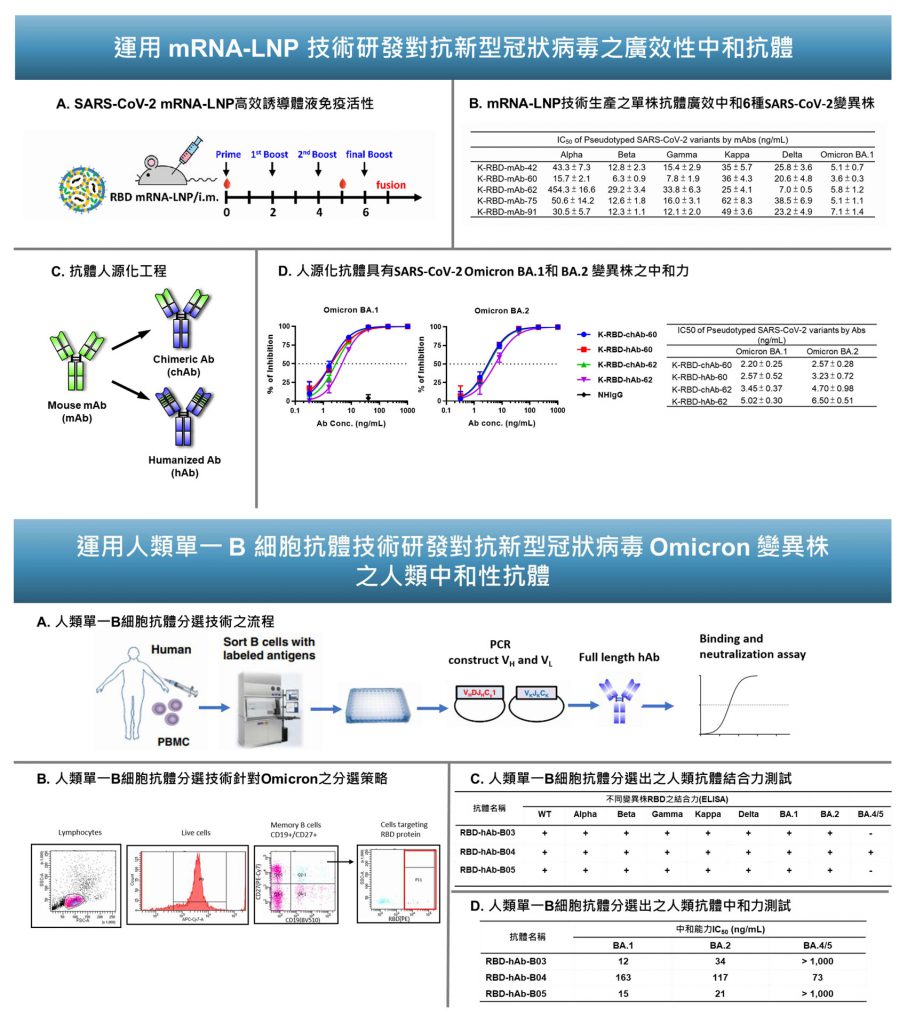
▲圖一:治療性抗體
抗體的應用:診斷試劑
若能快速、大規模而精準地篩檢出受新型冠狀病毒感染者,有助於病患的隔離與治療,便可以限制疫情發展。側向流體免疫層析法(LFIA, lateral flow immunochromatographic assay)發展對抗原或抗體進行的檢測的診斷試劑,快速且不需特殊儀器進行分析,適合運用於第一線防疫之大量篩檢。新型冠狀病毒之核殼蛋白(NP)在病毒顆粒中,扮演穩定 RNA 基因體的角色,因此序列較少突變,並且可以在感染者鼻咽處大量被偵測,是很理想的偵測標的。吳漢忠實驗室團隊在疫情大流行初期,即製備多種對抗核殼蛋白的單株抗體,用以開發新型冠狀病毒抗原快篩與血清抗體快篩(如圖二)。與慈濟大學合作開發之新型冠狀病毒血清雙抗體 IgG/IgM 快篩,於 2020 年通過台灣衛生福利部食品藥物管理署 EUA 後便積極進行國際人道救援,落實「Taiwan can help」。另外,團隊也積極研發抗體配對、靈敏度與特異性測試,以及臨床試驗後,於 2021 年 7 月完成研準新型冠狀病毒抗原快速檢驗試劑(防疫專案製造核准文號:1106810393),整體試劑準確率與靈敏度皆 ≥ 99%。於 Omicron 病患鼻咽檢體中,研準快篩可偵測 Ct ≤ 32.6 之臨床檢體,顯示研準抗原快速篩檢試劑對真實之 Omicron 變異株良好的偵測敏感度,可偵測包含 Omicron 與其他變異株,顯示此試劑不受突變株基因序列改變而產生干擾。特異性分析指出,此試劑也並不會辨認到 2003 年流行的 SARS 與其他常見呼吸道病原菌。與美國 EUA 醫護人士使用以目視進行判讀的新型冠狀病毒抗原快篩相較,其偵測靈敏度排名為第 6 名,顯示國內研發能力並不亞於國際。

▲圖二:診斷試劑
死亡與加冕
以病毒繁衍的角度而言,新冠病毒堪稱演化界的翹楚。不同變異株,尤其在中和性抗體辨識的棘蛋白上產生突變,造成中和性抗體無法結合與辨識,彷彿完美的易容術,躲避宿主免疫系統的追殺。因此在全球歡欣鼓舞地認為施打的疫苗、治療性抗體能有效的抑制新型冠狀病毒感染的同時,病毒突變正無聲醞釀著,直到成為下一個成功逃脫獵殺的變異株。新冠病毒大流行至今造成超過 670 萬人死亡,然而自然感染的康復者或疫苗接種者,體液與細胞免疫獲得防護力量的提升;另一方面亦促進人類醫療生技的進步,以因應病毒的快速突變以及新興病毒的崛起。綜觀而言,這未嘗不是新型「冠狀」病毒對人類免疫與生技的另一種「加冕」。
