女兒在游泳校隊的親戚問我:「妳在研究蛋白質?那要吃什麼蛋白質才可以頭好壯壯呢?」這是一般非科學人會問的問題,的確,蛋白質是人類營養不可或缺的一部分,因為蛋白質由胺基酸組成,蛋白質到了胃部會被分解成胺基酸,才被吸收再利用。但,難道蛋白質都是扮演好人的角色嗎?
非也。
大腦中有一種乙型類澱粉蛋白(Amyloid β , Aβ),是一種短鏈的蛋白質(或正確地說是胜肽),會經由堆積形成有毒的多倍體(或稱寡聚體,oligomer)和原型纖維(protofibrils),並最後會變成成熟纖維(mature fibrils)纖維狀物,繼而沉積在腦中形成阿茲海默症中的病理特徵——老年斑塊(senile plaques)。所以長久以來 Aβ 也被視為阿茲海默症的元兇之一。 阿茲海默症的病例特徵除了 Aβ ,還有形成神經糾結(neurofibrillary tangles)的 Tau 蛋白堆積。
然而今年頂尖的學術期刊 Science 刊登一篇偵查報導,質疑發表在 2006 年 Nature 的一篇重磅論文造假,這令國際社會感到震驚。其中的質疑點在於阿茲海默症(Alzheimer’s disease, AD,俗稱老年失智症)的病理蛋白——乙型類澱粉蛋白(Amyloid β , Aβ)的實驗數據。再加上 2021 年美國食品藥物管理局首次通過百健(Biogen)藥廠的 Aβ 抗體藥物aducanumab,因為其成效不張而飽受質疑。這皆使得 Aβ 成為眾人質疑的箭靶,懷疑它是否真的是阿茲海默症的原兇。
但局勢峰迴路轉,今年九月底日本衛采(Eisai)和百健(Biogen)藥廠公佈其合作的一株 Aβ 原型纖維抗體 Lecanemab,其第三期臨床試驗結果顯示:在治療 18 個月後,病人相較於安慰劑認知下降的程度減少了 27%。這是令人振奮的消息,雖然數據資料有待公佈,但這個消息再次將錯誤折疊的 Aβ 蛋白搬上王座。
回到最開始的問題,蛋白質都是扮演好的角色嗎?事實上,許多蛋白質都具有變壞的能力。但問題是,怎麼變?
變壞、變壞、變變變
蛋白質從一條 20 種胺基酸組成的胜肽鏈,要變成有功能的蛋白質,需要形成 3D 立體結構,而這個過程叫做蛋白質摺疊(protein folding)。在某些情況下糟糕摺錯了,就像魔術方塊回不到正方塊,美麗的摺紙摺不回原狀一樣,變成了怪形狀的醜八怪。這種情況稱為「蛋白質錯誤折疊(protein misfolding)」。
正常情況下,我們的細胞也有對付錯誤折疊醜八怪的方式,利用細胞內分子伴侶(molecular chaperons)或是清除機制(degradation)將它瓦解再分解掉。但偏偏總是會有出錯的情況,例如:老化、突變、環境毒素等,會讓錯誤摺疊的蛋白質漸漸堆積成垃圾山,大到細胞無法自行清除掉這些垃圾,而漸漸地細胞功能會喪失而死亡。
摺壞掉的蛋白質出現在很多器官,但產生嚴重疾病的大多都集中在中樞神經系統,當蛋白質沉積物出現在大腦小腦或脊髓,會造成不同的神經退化疾病,如:前面提及的阿茲海默症、額顳葉失智症(frontotemporal dementia, FTD,好發於中年的失智症)、肌萎縮性脊髓側索硬化症(Amyotrophic Lateral Sclerosis ALS,俗稱漸凍人)、帕金森氏症等。其中阿茲海默症和額顳葉失智症病徵皆為記憶喪失,全球恐怕已突破四千萬人。另外,帕金森氏症和漸凍人是運動神經元疾病,其中帕金森氏症尚有症狀藥物可以治療,而漸凍人是一種致命的罕見疾病,病人在 3 到 5 年內會漸進式的肌肉萎縮,由四肢擴散到全身肌肉,先是四肢癱瘓,再者無法言語和吞嚥,最終導致呼吸衰竭而死亡。
要怎麼研究壞壞蛋白質造成的疾病問題?
過去我們的研究著重在了解「蛋白質摺疊」與「錯誤摺疊機制所導致的疾病」。過去研究發現在阿茲海默症中 Aβ 異構物 Aβ 40 和 Aβ 42 具有不同的穩定性及組成,也發現其寡聚體並非一定要出現在類澱粉蛋白纖維化的路徑上 1,我們首度發現 Aβ 越穩定則越慢聚集成堆積路徑中所需形成的核種,而帶有家族性遺傳的突變 Aβ ,則易因為其不穩定而快速聚集 2。
大家常問重金屬是否會造成阿茲海默症呢?有甚麼解藥?的確,阿茲海默症腦中的老年斑塊具有高含量的鋅銅與鐵。另外,鋁離子也常被暗指與阿茲海默症相關。我們的團隊發現鋅離子與鋁離子會使 Aβ 穩定性下降,進而形成特殊的 Aβ 寡聚體 3。我們詳細鑑定了因鋅離子引發地 Aβ 寡聚體的蛋白結構,也證實其在老鼠腦中產生神經毒性 4。過往,我們與合作者從臺灣中草藥庫篩選三萬多種天然物分子,發現一天然小分子具良好的血腦障壁穿透性,其能抑制類澱粉的堆積和毒性,我們也設計合成了其他的小分子抑制物。同時,我們透過具生物相容性的奈米金粒子來了解「奈米材料在類澱粉疾病中可扮演的角色」,我們發現唯有帶負電的奈米金粒子可以抑制 Aβ 纖維化、促進纖維的解體和減緩毒性 5。這些研究皆有助於未來阿茲海默症的藥物發展。
專一抗體來擊退新型 TDP-43 蛋白質疾病了!
後來我們也漸漸將研究延伸到 TDP-43 蛋白質疾病上。TDP-43 蛋白是於 2006 年在額顳葉失憶症(FTD)及漸凍人症(ALS)中被發現的沉積物。我們首先將人類的 TDP-43 全長蛋白純化出來,發現它會快速地聚集成具有神經毒性的球狀寡聚體 6。更進一步製作出能專一辨認 TDP-43 球狀寡聚體的專一抗體,其不會辨識生理上具有正常功能的 TDP-43,期許它能夠成為一個抗體新藥。這個專一抗體只打擊錯誤摺疊的 TDP-43 壞蛋,而不去攻擊正常功能的好 TDP-43 蛋白。聽起來是不是很棒呢?
目前我們已生產了具結構專一性的小鼠單株抗體,每週靜脈注射到 ALS 小鼠模型中,再讓小鼠跑健身滾輪,發現:相較於注射控制組抗體的小鼠,注射了這個抗體的小鼠跑得比較為持久,其後肢張力也維持正常,運動神經元的數量也顯著地比較多,因此我們在小鼠體內證明了這個抗體的治療功效。
然而,我們可不是要治療漸凍小鼠,這個藥需要打到人體內。因此,為了進一步開發這個抗體的潛力,我們開始在製作人源化的抗體,也就是把抗體序列大多換成人類的序列,但仍保留它辨認錯誤摺疊 TDP-43 壞蛋白的功能。另外,專一抗體也有作為生物標記(biomarker)的潛在可能性,透過專一抗體與一些精密檢測技術,可以觀測病程並協助藥物開發,當然能夠用來診斷病情是在好不過的了。總而言之,此抗體在 ALS 症中具有極大治療及診斷潛力。
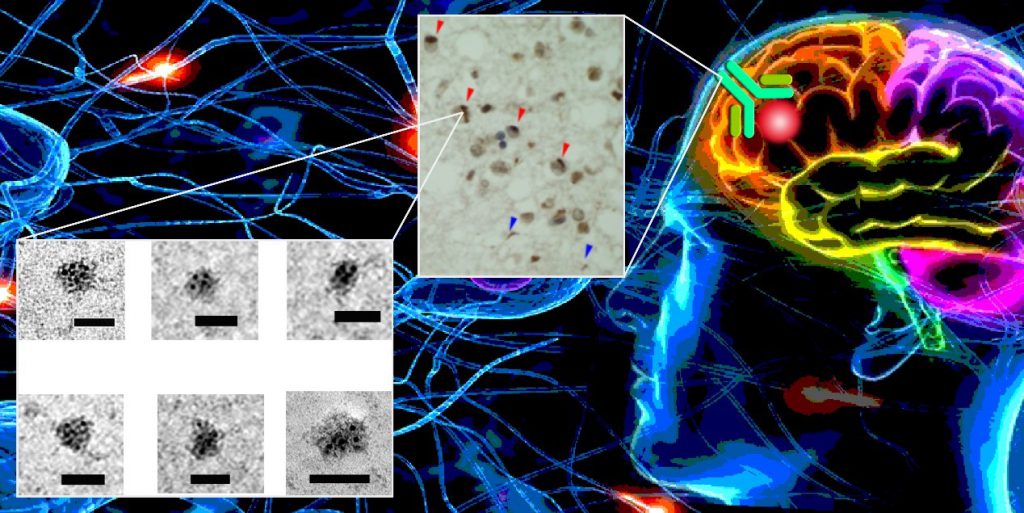
▲藉由專一抗體(綠色的 Y 字型)可以免疫染色出病人腦組織中的病理蛋白(中圖),也可以免疫沉澱出這個元凶(左圖,電子顯微鏡圖)6。
關鍵的第三者出現了!
阿茲海默症中除了已知的 Aβ 和 Tau 蛋白堆積,近年來在許多阿茲海默症患者腦中發現了第三者!它竟然是 TDP-43 蛋白沉積物……
TDP-43 蛋白不是僅被發現在 95%ALS 和 50% 額顳葉失智症病人病理中沉積物,現在居然也跨界到了阿茲海默症?的確,國外阿茲海默症病理中心分析高達三百多位過世後捐腦的病人,其病程數據及腦組織病理顯示:高達 57% 大腦帶有 TDP-43 蛋白沉積物的病人出現更快速的病程和更大規模的腦萎縮。
但這第三者到底怎麼干擾主事者?
其實,我們先前就觀察到全長 TDP-43 寡聚體會干擾 Aβ 的纖維化過程。我們接續著深入研究 TDP-43 在阿茲海默症中的角色 7。我們發現 TDP-43 可以在 Aβ 聚集過程的初期和中期透過交互作用影響並抑制 Aβ 長成纖維,此作用使得過程中的 Aβ 寡聚體也增加了。
在小鼠行為實驗中,我們注射 TDP-43 誘導的 Aβ 到正常小鼠腦中,小鼠會有顯著惡化的空間記憶損傷。而使用基因轉殖的阿茲海默症模式鼠,注射 TDP-43 也有一樣的問題,並且引起大腦中的發炎反應。我們也確認 TDP-43 與 Aβ 有相互作用,並加劇了阿茲海默症病徵。更重要的是,我們發現 TDP-43 寡聚體在阿茲海默症患者大腦的神經細胞內與 Aβ 座落於同一個位置。因此,我們的研究提供了 TDP-43 這個第三者,透過相互作用抑制主事者 Aβ 的纖維化,並加劇了 AD 病徵的分子機制。
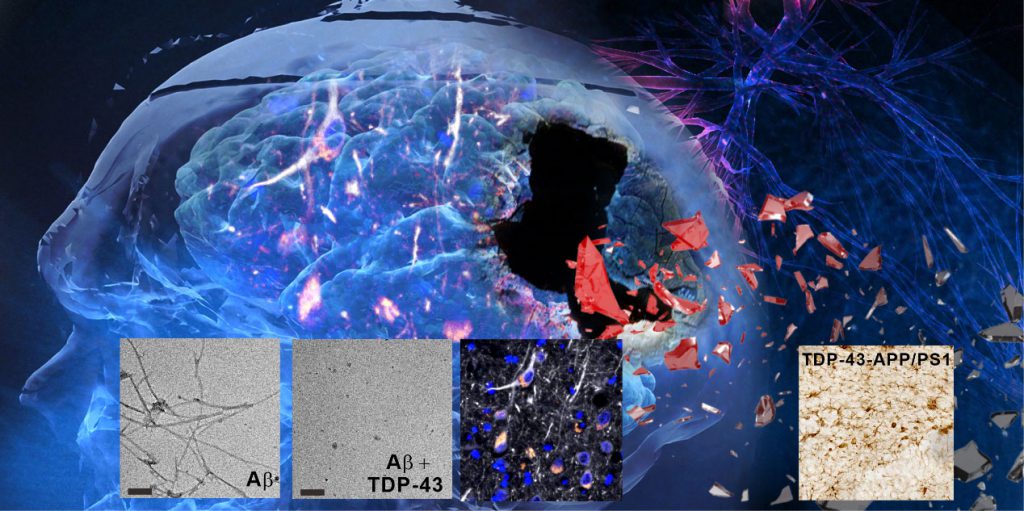
▲ TDP-43 寡聚體惡化阿茲海默症病徵。 TDP-43 寡聚體抑制 Aβ 纖維及誘發 Aβ 寡聚體形成(左圖一二,電子顯微鏡圖)。TDP-43寡聚體和 Aβ 座落於在阿茲海默症大腦的神經細胞內(中圖)。TDP-43 寡聚體引起發炎反應(右圖)。
未來展望
說到這邊,曾經有一位天資聰穎、拿過奧林匹亞金牌的高中生告訴我,他覺得神經退化疾病是不可逆的,可以把精力放去研究其他事情。 當時我覺得這樣說好像也沒什麼錯,但是心裡有點難過。我告訴他:那也許是因為你現在還年輕,家裡也沒有人生病的關係。
對於自身經歷過家中長輩有神經退化疾病患者的我,還記得每一日的週旋對話,是像這樣的:
祖母憂心忡忡地走來走去、喃喃自語:「小孩不見了,我要去找小孩!」,我說:「什麼小孩?我已經長大了」她又生氣地說,「我顧的小孩,妳不懂啦!」。然後走開,五分鐘後,又憂心忡忡地走來:「妳有沒有看到我顧的小孩?」原來祖母的腦筋迴路只停留在她以前做保母幫忙顧小孩的時期,而且這個迴路每五分鐘就重來一遍。更別提她去市場買十幾顆高麗菜回家放在陽台放到爛,但還是每天要去買;拿著盤子對著電視煮菜節目的人說,這個菜很好吃的樣子可不可以分我一點;還到處藏錢,藏物品,走失走丟等問題。
這種退化的情況整整持續了 20 年,想想家屬的辛酸。更別提漸凍人在中年發病,即便智力都正常卻漸漸喪失肢體與語言能力,像是被囚禁的靈魂,也可能來不及看孩子長大。
然而,不只是神經退化疾病,還有太多疾病。身為研究者,或是科研小小兵,我們要知道人類最偉大的就是夢想,有夢想就有希望。雖然人免不了生老病死,但科學研發確切根除某些疾病或是延緩病程。不去研究就沒有機會,研究就算是失敗,過程卻會留下發芽的幼苗。回到最近的 Aβ 抗體成功的新聞,這不就應證了「堅定信念」的道理嗎?
往後請社會大眾繼續支持並參與科學研發,人類與世界才能持續的進步。
參考文獻
1.Chen, Y. R.; Glabe, C. G., Distinct early folding and aggregation properties of Alzheimer amyloid-beta peptides Abeta40 and Abeta42: stable trimer or tetramer formation by Abeta42. J Biol Chem 2006, 281(34), 24414-22.
2.Ni, C. L.; Shi, H. P.; Yu, H. M.; Chang, Y. C.; Chen, Y. R., Folding stability of amyloid-beta 40 monomer is an important determinant of the nucleation kinetics in fibrillization. FASEB J 2011, 25(4), 1390-401.
3.Chen, W. T.; Liao, Y. H.; Yu, H. M.; Cheng, I. H.; Chen, Y. R., Distinct effects of Zn2+, Cu2+, Fe3+, and Al3+ on amyloid-beta stability, oligomerization, and aggregation: amyloid-beta destabilization promotes annular protofibril formation. J Biol Chem 2011, 286(11), 9646-56.
4.Lee, M. C.; Yu, W. C.; Shih, Y. H.; Chen, C. Y.; Guo, Z. H.; Huang, S. J.; Chan, J. C. C.; Chen, Y. R., Zinc ion rapidly induces toxic, off-pathway amyloid-beta oligomers distinct from amyloid-beta derived diffusible ligands in Alzheimer’s disease. Scientific reports 2018, 8(1), 4772.
5.Liao, Y. H.; Chang, Y. J.; Yoshiike, Y.; Chang, Y. C.; Chen, Y. R., Negatively charged gold nanoparticles inhibit Alzheimer’s amyloid-beta fibrillization, induce fibril dissociation, and mitigate neurotoxicity. Small 2012, 8(23), 3631-9.
6.Fang, Y. S.; Tsai, K. J.; Chang, Y. J.; Kao, P.; Woods, R.; Kuo, P. H.; Wu, C. C.; Liao, J. Y.; Chou, S. C.; Lin, V.; Jin, L. W.; Yuan, H. S.; Cheng, I. H.; Tu, P. H.; Chen, Y. R., Full-length TDP-43 forms toxic amyloid oligomers that are present in frontotemporal lobar dementia-TDP patients. Nat Commun 2014, 5, 4824.
7.Shih, Y. H.; Tu, L. H.; Chang, T. Y.; Ganesan, K.; Chang, W. W.; Chang, P. S.; Fang, Y. S.; Lin, Y. T.; Jin, L. W.; Chen, Y. R., TDP-43 interacts with amyloid-beta, inhibits fibrillization, and worsens pathology in a model of Alzheimer’s disease. Nat Commun 2020, 11(1), 5950.
