利用顯微鏡來探索微小世界,大概是最能夠滿足人類好奇心的方法之一。如果你在網路上把「科學家」當作關鍵字搜尋圖片,就會發現有一堆照片都是在光學顯微鏡旁邊拍攝的。儘管有許多科學研究與顯微鏡並無直接關聯,但是「顯微鏡」在人類科學進展上扮演的獨特角色已經不言而喻。

▲筆者實驗室開發之「同調式明場顯微鏡(COBRI microscopy)」
現今光學顯微鏡已經與商業活動緊密結合,從給兒童使用的簡易顯微鏡,到生物實驗室經常性使用的解剖顯微鏡,甚至是高階的研究用超解析顯微鏡,種類包羅萬象;除了幾個國際大廠之外,也有數不清的小公司,發展獨特的顯微鏡技術。對科學研究來說,什麼樣的顯微鏡才算是好呢?你或許會毫不猶豫的回答,當然是要看得見最微小的東西啊!但這個問題的答案沒有這麼簡單。
如果說終極的目的是要看最微小的東西,那麼或許應該考慮使用電子顯微鏡。你曾聽說過光學顯微鏡的解析度的極限嗎?因為光波的繞射性質,顯微鏡的解析度,是由光的波長決定的 [1](這也是為什麼半導體製程會需要用到極短波長的紫外光)。波長越短,在與物質交互作用後,就越能夠展現物體小尺度的細節。有別於光學顯微鏡是利用光和物質的交互作用來成像,電子顯微鏡是利用電子和物質的交互作用,而電子的波長遠比光子來得短,所以電子顯微鏡更能夠提供高解析度的顯微影像(事實上,當今最先進的電子顯微鏡技術已經可以看見一個個原子 [2])。然而,在許多生物研究中,科學家希望能夠在不破壞生物系統的條件下連續觀察生命現象,而電子顯微鏡的操作需要真空,且電子對生物樣品具有破壞性,因此並不適合活體生物研究。反觀,光對生物系統的侵入性低(侵入性與光的波長有關),這正是為什麼光學顯微術在生物研究上,扮演著不可或缺的角色。
雖然光對生物系統的影響較小,但對於生物學家來說,光學顯微鏡的觀察對生物系統的影響必須更謹慎的評估,否則就算觀察到再精緻的影像,也可能是生物系統受到「觀察的干擾」後所產生的偽現象,甚至導致錯誤研究結論的嚴重後果。因此,如果可以的話,科學家傾向對生物樣品做最少的處理,顯微鏡觀察時用最少量的光,觀察的環境也要盡量適合生物活動進行。
為使光學顯微鏡技術能和生醫研究緊密結合,科學家們常常希望顯微鏡影像能夠具有「功能性(functionality)」和「專一性(specificity)」。例如,當觀察細胞群體時,有些科學家可能會希望能夠觀測每一隻細胞的健康狀況和代謝效率,有些科學家則是希望清楚的看見細胞核內 DNA 的分佈和粒線體的位置和數量。為了達到這些目的,科學家會針對顯微影像的目的,設計具有獨特光學特性的小分子,利用「染色」的方式,將小分子標記(label)在具有特定功能或者特定細胞結構上,透過選擇性的標記,光學顯微影像就能夠提供具有功能性和專一性的資訊了。
染色標記的方法十分強大,世界上有許多科學家發展各式各樣的標記,讓複雜的生物現象得以在顯微鏡下觀察。一個成功的標記必須將希望觀察的標的轉化為光學顯微鏡量測的訊號,這看似簡單的原理,實際應用上卻千變萬化。例如,為了觀察腦組織中神經細胞的訊號傳輸,科學家發明了對神經細胞活性相關的鈣離子敏感的螢光蛋白,藉此可以透過螢光顯微鏡觀察到神經訊號在空間中傳遞 [3]。
透過標記,光學顯微鏡獲得了巨大的成功。但是,越來越多科學家注意到了標記可能造成的問題。首先,在分子的尺度,所有的標記都必然與所觀察的生物系統存在某種交互作用,例如標記必須透過一些機制依附在特定細胞結構上,雖然標記通常都很小(依標記種類不同可以從一個奈米到數個奈米不等),但被依附的生物分子仍可能因為此標記而無法完成原先該完成的生物現象。
不當或過多的標記都會影響生物系統,舉例來說,有時候,科學家會希望同時觀察生物系統幾個會相互影響的現象,例如:腦內多巴胺的分佈與神經細胞活性之關聯,這時候就需要同時使用對應的標記,在這種情形下,就更需要費心驗證標記的適用性。另外,常用的螢光標記在照光後所產生自由基(radical)會造成光毒性(phototoxicity),破壞細胞的結構甚至造成細胞死亡 [4]。
因此,每一個科學研究都必須驗證所採用的標記不影響研究結果才行。然而,要如何證明標記不影響研究結果呢(畢竟如果不標記,就無法對樣品進行觀察)?以前述的電位訊號標記為例,科學家就必須盡力用其他研究方法確認,當神經細胞被標記了之後,其結構和腦部活動等皆不受影響,這樣的驗證十分費力,也很難保證標記完全不影響生物現象。受限於標記所衍生出的問題,近年來,一群科學家開始思考,是否能夠在不用標記的情況下,取得具有功能性與專一性的顯微影像?
讓我們回過頭來看早期人類所發明的顯微鏡:它是利用樣品與光的交互作用,實現顯微成像的結果。這裡指的交互作用,指的是散射、吸收、反射這些最基礎的光學現象;這些現象只需要樣品具有與周圍環境不同的折射率就會發生,不需要染色標記,因此廣泛適用於所有生物樣品。 早在 1953 年,科學家 Frits Zernike 便發現,生物細胞雖然看似透明,但是它會改變照射光的相位(phase),因此透過獨特的相位差光學顯微鏡(phase contrast microscopy)設計,將光的相位資訊轉換成亮度,就可以清楚的看見細胞。這個發明獲得了諾貝爾物理獎的肯定,該技術一直到今天,仍然是生物細胞實驗室在觀察細胞培養狀況時,廣泛使用的光學顯微鏡,因為它讓科學家可以在「免標記(label-free)」的情況下,觀察最原始的生物現象。
免標記顯微術依賴光的散射、吸收、反射,而這些現象通常不具有「功能性」和「專一性」。近年來,科學家們開始發展新一代的免標記顯微術,希望能在最接近自然的情況下研究生命現象。在眾多免標記顯微術中,本文將著重在線性散射式(linear scattering)光學顯微術,其他免標記顯微術,例如:拉曼顯微術、非線性光學顯微術等,請讀者參考其他文章 [5, 6]。
線性散射式顯微鏡顧名思義,就是量測樣品的線性散射訊號,該技術進展的第一步,就是提升顯微鏡的靈敏度。因為散射的特性,對於遠比光波長小的奈米物體而言,線性散射的訊號強度會因為散射物體體積的縮小快速衰減(散射強度與物體體積平方成反比),因此要量測到生物分子的散射訊號,技術上是相當困難的。近年來,筆者和幾個國際研究團隊,利用干涉的方法和雷射技術,成功的量測非常微小的物體的散射訊號 [7-9]。這開啟了過去所無法進行的一系列實驗。
試想,如果我們可以「看見」組成細胞的每一個分子(而且不用標記!),生物顯微影像技術將從此大不相同。此外,相較於螢光,線性散射訊號具有高度的穩定性,因此不受光漂白現象(photobleaching)的限制,可以長時間(連續好幾天)對樣品進行觀察。
當影像靈敏度提升後,免標記顯微鏡下會觀察到許許多多微小的分子和細胞結構。然而,光是看見很多細節,卻常常無法對生物研究產生助益,因為線性散射是沒有分子或結構專一性的,所以無法了解到底這些結構是什麼。以籃球比賽為例,如果兩隊球員和裁判都穿上相同的球衣,就算看見了每一個人,仍然很難判斷誰是誰了吧?
筆者的研究團隊最近發表了一項研究成果,提出了「動態影像(DYNAMICS imaging)」的概念,從免標記散射量測數據,重建具有分子專一性的影像[10]。「動態影像」的基本精神是,雖然很多分子和結構的散射訊號強度相近,但因為它們生物的性質不同,所以會具有不同的動態特性,因此有機會從時間尺度上分辨不同分子與結構的訊號。回到籃球比賽的例子,如果你看得見球員的跑動,就算球衣相同,有經驗的觀眾應該就能分辨是誰在進攻,誰又在防守了吧!
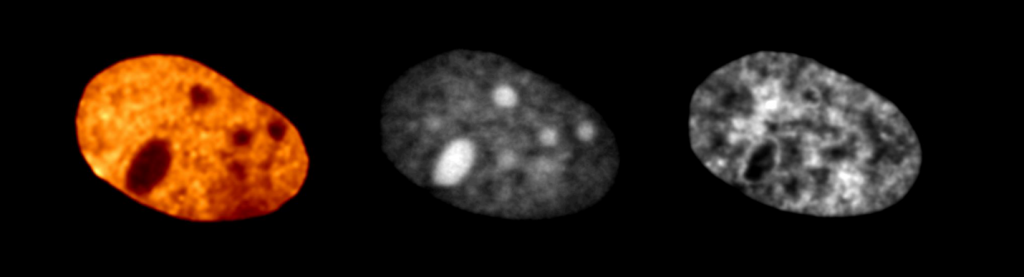
▲免標記細胞核染色質影像(左),核仁螢光染色影像(中),DNA 螢光染色影像(右)
利用「動態影像」技術,筆者的研究團隊成功實現了在活體細胞中,免標記、高解析度的染色質顯微影像,並且透過此技術探討了奈米尺度下染色質的凝聚現象 [10]。此現象和細胞基因的表達有密切關聯,也因此與老化現象或癌症等疾病相關。此外,透過機器學習(machine learning),筆者以及其他國際研究團隊更進一步將複雜的動態訊號與螢光影像結合,藉此克服了傳統免標記顯微術的缺點,實現具有專一性與功能性的免標記光學顯微影像[11]。
未來,只需要一次免標記的顯微影像觀察,透過影像分析,就如同切換不同濾鏡一樣,可以在不同分子與功能間切換,從不同生物角度剖析;這樣的科技已經不再是夢想,更多具有功能性和分子專一性的免標記技術,必然會實現。
如果可以不用標記就能看得清𥇦,還有誰會使用標記?
[1] 陳思妤, 光學顯微術的極限運動, 物理雙月刊, 38(6), 13(2016).
[2] 路易吉.拉斯波里尼(Luigi Raspolini), 電子顯微鏡:揭開肉眼看不見的世界, 科學月刊 628 期(2022)。
[3] 活躍星系核, 打開大腦運作的黑盒子:神經活動的即時影像是如何運作的, 泛科學(2018)https://pansci.asia/archives/146377。
[4] Laissue, P., Alghamdi, R., Tomancak, P. et al. Assessing phototoxicity in live fluorescence imaging.Nat Methods 14, 657–661(2017).
[5] Pezacki, J., Blake, J., Danielson, D. et al. Chemical contrast for imaging living systems: molecular vibrations drive CARS microscopy. Nat Chem Biol 7, 137–145(2011).
[6] 朱士維, 孫起光, 多模態非線性顯微影像術, 科儀新知, 22(6), 77(2001).
[7] Huang, Y.F., Zhuo, G.Y., Chou, C.Y. et al. Coherent brightfield microscopy provides the spatiotemporal resolution to study early stage viral infection in live cells. ACS Nano, 11(3), 2575-2585(2017).
[8] Young, G., Hundt, N., Cole, D., et al. Quantitative mass imaging of single biological macromolecules. Science, 360(6387), 423-427(2018).
[9] Heermann, T., Steiert, F., Ramm, B. et al. Mass-sensitive particle tracking to elucidate the membraneassociated MinDE reaction cycle. Nat Methods 18, 1239-1246(2021).
[10] Hsiao, Y.T., Tsai, C.N., Chen, T.H., Hsieh, C.L. Label-free dynamic imaging of chromatin in live cell nuclei by high-speed scattering-based interference microscopy. ACS Nano, 16(2), 2774(2022).
[11] Hsiao, Y.T., Tsai, C.N., Cheng, C.Y., Hsieh, C.L. Molecularly specific and functional live cell imaging by label-free interference microscopy. ACS Photonics, 9(7), 2237-2245(2022).
