你是否曾經問過大腦「你累了嗎?」為何大腦總能不停的發出快速卻精準的指令呢?大家都略知你我的大腦是由許多不同的神經細胞所組成,但真實數量是多少?答案是上千億個!很難以想像吧?
每一個神經細胞都有著非常與眾不同的外表,它長得就像一棵樹,會利用樹枝的末端把各個神經細胞串聯成眾多彼此不同的腦迴路,透過這些迴路之間的交互傳達訊息或是傳送神經傳導物質,支配我們日常中各種行為。所以如何能持續不停地把訊號從一個神經細胞傳到另一個神經細胞,是大腦運作的重要關鍵。
現在你一定迫不及待想知道這些樹枝之間到底隱藏著什麼樣的秘密?研究驚奇的發現,這神秘面紗背後居然是由一群猶如「小玻璃彈珠」的物質包著神經傳導物質,它們能把神經傳導物質丟出神經細胞外,接著就能把訊息傳給另一個神經細胞。更意想不到的是,大腦好像喝了提神飲料一樣,能夠將用過的彈珠一直回收再重複利用,如此一來大腦在釋放神經傳導物質上就不虞匱乏了。今天就讓我們打開這罐「蠻牛」,看看它為什麼那麼「牛」!
「小玻璃彈珠的物質」其實是神經特化出的「突觸小泡」
如果我們往細部觀察(圖一),在大腦中,串聯在一起的神經細胞大部分非直接相連,樹枝狀的神經結構通稱之為「軸突」與「樹突」,而軸突的末端能與來自於另一個神經細胞的樹突一同形成幾個微米大小的特化結構,我們稱之為「突觸(Synapse)」。軸突與樹突末端分別形成「前突觸區」與「後突觸區」,這之間有著大約20到50奈米極短的距離。
前突觸區儲存著許多直徑介於30到50奈米大小脂質構成的「突觸小泡」(Synaptic vesicle),它就是我上述提到「小玻璃彈珠的物質」的真實身分,神經傳導物質會被包進突觸小泡內。神經細胞與其他細胞一樣,細胞表面是由脂質膜狀物質所構成,神經刺激會促進突觸小泡與神經細胞表面脂質膜融合,進而釋放所包含的神經傳導物質,隨後另一個神經細胞就會接收傳來的訊息。
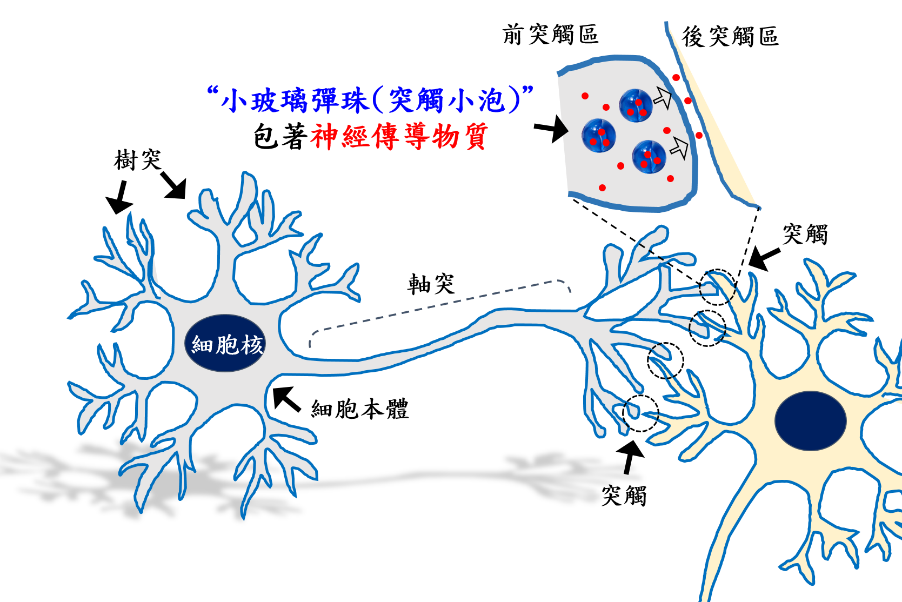
▲圖一:神經細胞透過突觸傳送訊息“突觸小泡”讓大腦釋放神經傳導物質變的隨心所欲了
一個很直覺的問題是,為何需要大費周章把神經傳導物質先包進突觸小泡內再做釋放呢?神經傳導物質以胺基酸、多肽與嘌呤所組成,皆在神經細胞質中生成,已知它們分子的特性導致無法直接穿透細胞表面脂質膜而被釋放出細胞外,這也造就「突觸小泡」特化而生了!
突觸小泡製造於神經細胞本體,接著一路順著如高速公路一般的軸突,被運送到前突觸區暫存,它們能透過一個自我酸化的過程來啟動神經傳導物質灌入,猶如填滿彈藥一般的突觸小泡接著被一步一步引導到特定釋放的地點,稱之為「激活區」。那誰來當專業的導遊呢?自1986年以來,Thomas C. Südhof博士為主的科學家一同努力的研究發現,突觸小泡自己會攜帶一些蛋白質,例如Rab與SNARE等蛋白質,透過Rab與細胞微管運輸系統的交互作用,把突觸小泡帶到激活區附近,接著利用位於突觸小泡上的SNARE蛋白與座落在激活區上的SNARE蛋白結合形成蛋白複合體,突觸小泡就能在激活區待命著。
在激活區上,神經刺激導致鈣離子通道打開,鈣離子就順利的從神經細胞外快速流入細胞內,這時高濃度的鈣離子做了一件很重要的事,它會與突觸小泡上的Synaptotagmin蛋白結合而改變此蛋白的構形,如變形金剛般的Synaptotagmin蛋白可大大增強SNARE蛋白複合體內的結合力道,進而驅使突觸小泡與細胞表面脂質膜進行融合,整個過程也稱之為「突觸小泡胞吐作用」。
因此透過突觸小泡,就可讓神經傳導物質的釋放緊緊被神經刺激控制著。另一方面,突觸小泡具有非常固定的大小,可讓包進每一顆突觸小泡的神經傳導物質在數量上也很一致,所以隨著神經刺激的強度越強,等比量的神經傳導物質就能被釋放出去了。有突觸小泡在,大腦在釋放神經傳導物質上,真的能隨「神經刺激」所欲了,簡直是造物者的精心傑作!Thomas C. Südhof博士與其他兩位科學家在2013年一同獲頒諾貝爾生理學和醫學獎,此殊榮用於感謝他們在闡明細胞內膜運輸系統的運行機制在人類生理維持上有極大貢獻。
「突觸小泡胞吞作用」又是什麼?為何它能讓胞吐作用盡情的發揮?
突觸小泡從神經細胞本體製造出後,會以大概平均每秒3微米的運輸速度被運到前突觸區,大腦神經軸突約莫幾毫米長,推算需十幾分鐘才能到達目的地,那如像一公尺長的坐骨神經軸突,就要花上4天。另一方面,大腦神經往往會接收到介於每秒幾十到幾百下的刺激,預估在短短幾秒連續的刺激後,存放在前突觸區的突觸小泡將會全部進行胞吐作用,但事實上,大腦總能一直運作著,這也代表突觸小泡不會被用完,這背後神奇的機制為何呢?
在1970年代,研究學家利用電子顯微鏡觀察位於青蛙神經與肌肉連接觸所生成的前突觸區,首次發現融合後的突觸小泡看似能在激活區周圍被回收再形成,之後這過程被稱為「突觸小泡胞吞作用」,它就是能讓突觸小泡一直被循環利用的神秘力量!從此以後,隨著各式顯微鏡技術的快速演進與各種模式生物系統(包含果蠅、線蟲、老鼠等)接著投入研究行列。直到目前,已發現有四種模式的突觸小泡胞吞作用,它們是依據不同的發生地點、不同的發生時間、不同的能引發它發生的神經刺激強度所分類(圖二)。
第一種模式:突觸小泡胞吐後,在還沒有完全融合的狀況下就與細胞脂質膜分離被回收,回收過程約一秒鐘內完成,顧名思義被命名為「蜻蜓點水式的胞吞作用」。
第二種模式:突觸小泡胞吐後,會完全與細胞脂質膜融合,突觸小泡回收發生只在激活區周邊區域,過程中網格蛋白複合體會協助單一突觸小泡生成,已知回收過程耗時十幾秒到半分鐘完成,這模式稱之為「網格蛋白介導的胞吞作用」。
第三種模式:是近年來將快速冷凍顯微技術結合光遺傳學技術下意外發現的新模式,它只需幾十個毫秒就可在激活區邊緣形成一個約一百微米大小的大泡,接著透過網格蛋白介導的胞吞作用生成單一突觸小泡,因此被命名為「極速胞吞作用」。
第四種模式:只會受強神經刺激誘發,發生於激活區周邊區域,在幾秒內一次的回收多數個突觸小泡,形成一個幾百微米大小的大泡,接著也透過網格蛋白介導的胞吞作用生成單一突觸小泡活性,被稱為「神經活性依賴的大量胞吞作用」。
目前推測多種模式共存可讓不同性質的大腦神經細胞用來應付各自的特殊需求。
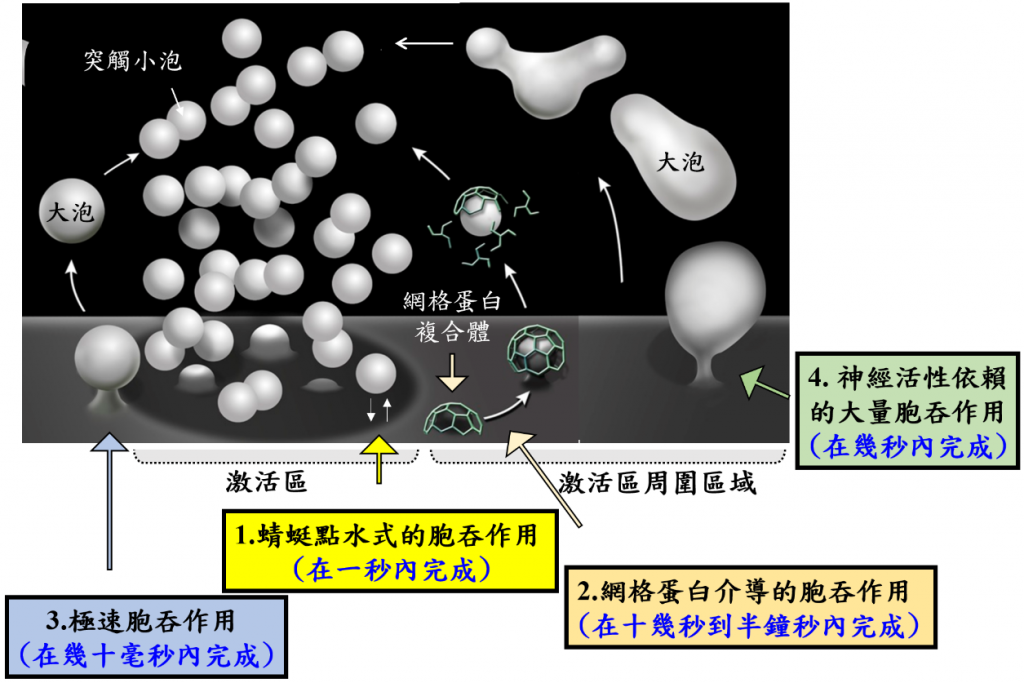
圖二:突觸小泡胞吐模式。附圖是從文獻(Wu et al., eLife, 2014)改編
突觸小泡胞吞作用還有其他重要任務
突觸小泡表面不像光溜溜的玻璃彈珠表面,每一個突觸小泡上其實是被各式各樣的蛋白所占滿,大部分的蛋白是用來協助突觸小泡來執行它的功能,但問題是,突觸小泡胞吐後也會將這些蛋白撒在激活區上,影響激活區的功能。最新的研究也發現,參與在突觸小泡胞吞作用的蛋白也能額外協助清除推積的突觸小泡蛋白,進而讓新一波的突觸小泡胞吞作用能順利完成。這也再次顯示突觸小泡胞吞作用對大腦而言是不可或缺的。
突觸小泡胞吞作用發生總是緊緊跟在胞吐作用後
從前面突觸小泡胞吞作用發生時間的介紹中,你應該和大部分的科學家都觀察到一個很有趣的現象了吧!就是不管任何模式的胞吞作用總能在胞吐作用發生後被即時啟動,只是不同模式所需的時間長短不一樣,但你可以想像,有了胞吞作用無縫接軌般的串聯,突觸小泡就可即時的被回收,以及新一波的突觸小泡胞吐作用能維持在高效率,但參與在這重要過程的分子機制尚未明朗。接下來就介紹我實驗室過去在這方面所做的研究與有趣的發現。
「花」離子通道蛋白幫助突觸小泡胞吐與胞吞作用「攬牢牢」
2006到2011年間,當筆者還在美國休士頓貝勒醫學院從事博士後研究時,當時借重果蠅(Drosophila melanogaster)模式生物在科學研究上的幾大優勢:果蠅與人類大部分的基因功能類似、好飼養、生殖週期短、個體小可在一定固定空間飼養大量蟲體,更重要的是,與老鼠、斑馬魚相較之下,果蠅具最完備的遺傳學與神經生物學相關的技術。接著我們進行了一個針對幾萬隻果蠅的大規模基因突變篩選實驗,我們給果蠅餵食基因突變劑,接下來量測這些突變果蠅眼睛對光的反應,進而篩選出一群「釋放神經傳導物質有問題的突變果蠅株」。
果蠅跟人類很像,周邊運動神經會與肌肉發育成近似大鈕扣狀的前突觸區,有趣的是,其中幾株突變果蠅的前突觸區會發育成很不一樣的型態,很像綻放中的花朵,當我們找到發生突變的基因後,給了這基因一個好記卻又典雅的名字--花(Flower)。
綜合當時到現在我自己的實驗室裡所做的研究結果,我們發現當神經細胞還沒受任何刺激前,花蛋白看似悠悠哉哉座落在突觸小泡上(圖三)。有趣的是,隨著神經受到刺激,突觸小泡與細胞脂質膜融合的同時,花蛋白也因此被「轉移」到激活區,甚至到其周邊區域,那正是發生胞吞作用的熱點。此時此地的花蛋白可將網格蛋白介導的胞吞作用誘發了起來。更神奇的是,在激活區周邊區域的花蛋白居然還能控制另一模式的胞吞作用,但這只有當神經細胞受強刺激後才會發生。
我們證實花蛋白也具有離子通道的功能,可讓鈣離子通透,花蛋白對弱的神經刺激一點都不為所動,可是強的神經刺激卻能活化它的離子通道功能,此時「心花怒放」的花蛋白,會迅速提升前突觸區內的鈣離子濃度,接著促進神經活性依賴的大量胞吞作用的發生。當突觸小泡胞吞作用啟動後,胞吞作用會把花蛋白回收到新生成的突觸小泡上,就像順手關掉開關一樣,終止這一波的胞吞作用。我們推測突觸小泡可以假「花離子通道蛋白」之手,將突觸小泡胞吐與胞吞作用「攬牢牢」,隨後也控制突觸小泡自己的回收再利用,造就了一個非常精緻的串聯機制。
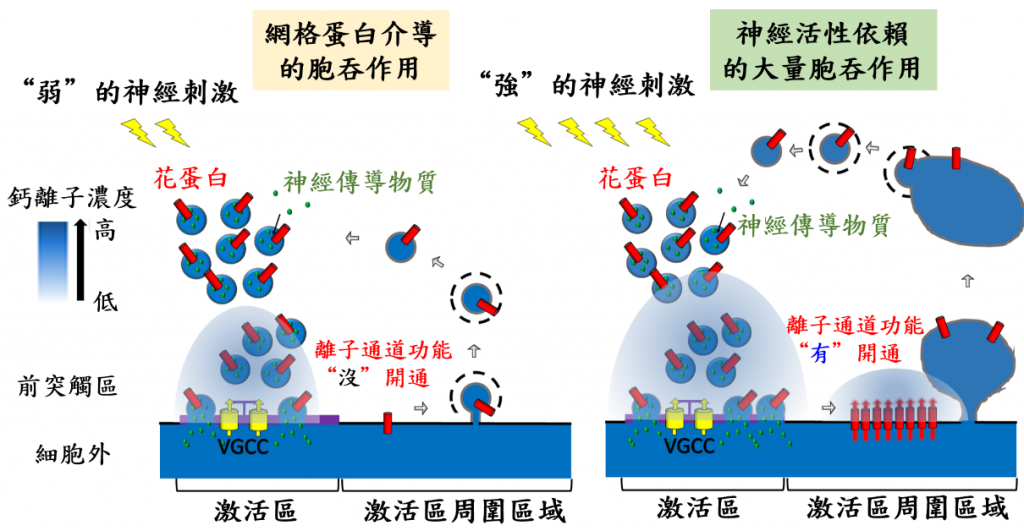
圖三:花鈣離子通道蛋白控制突觸小泡胞吐與胞吞作用串聯與誘發突觸小泡胞吞作用。VGCC為控制突觸小泡胞吐作用的鈣離子通道蛋白。
神秘的面紗只掀到了一半!
至此還存在許多疑惑等待我們去揭曉答案。首先,令人百思不解的問題是,突觸小泡胞吐作用後,每個突觸小泡會把它自身攜帶各式各樣不同種類的蛋白散落在激活區,此時如何在極短的時間將它們精準地回收到新生的突觸小泡上呢?
接著是,不同模式的突觸小泡胞吞作用不僅在形成時間上有很大的不同外,而且能發生在不同的前突觸區域,分子機制又是為何呢?已知人體中有著各式各樣不同特性的神經細胞,它們在神經傳導物質釋放的特性上也很不一樣,是否這特異性是由於不同突觸小泡胞吞作用模式在使用程度上不一樣所導致的呢?
在人類疾病上,神經細胞一旦在幼兒時期到青少年期間發育完成後,就會伴隨著我們一生,近年來許多證據已指出效率變差的突觸小泡胞吞作用與神經疾病的發生有著密不可分的關聯性,但為何這些疾病會引發突觸小泡胞吞作用失能?另一方面,突觸小泡胞吞作用失能如何引起神經退化的呢?
期望未來能破解上述問題,得到的答案應可促使我們對人腦錯綜複雜的運作能更加瞭解,以及對於現存許多棘手的神經疾病治療上,提供更好的良方。
延伸閱讀
1.Li TN, Chen YJ, Wang YT, Lin HC, Lu TY, (Yao CK)* (2020-12) Elife 9, e60125 “A positive feedback loop between Flower and PI(4,5)P2 at periactive zones controls bulk endocytosis in Drosophila.”
2.Yao CK, Liu YT, Lee IC, Wang YT, Wu PY (2017-04) PLoS biology 15(4), e2000931 “A Ca2+ channel differentially regulates Clathrin-mediated and activity-dependent bulk endocytosis.”
3.Yao CK, Lin YQ, Ly CV, Ohyama T, Haueter CM, Moiseenkova-Bell VY, Wensel TG, Bellen HJ (2009) Cell 138(5), 947-960 “A synaptic vesicle-associated Ca2+ channel promotes endocytosis and couples exocytosis to endocytosis.”
