新型冠狀病毒疾病(以下簡稱COVID-19)疫情爆發以來,已經造成全球1.9億人確診,並有超過410萬人染疫死亡。在全球面對COVID-19疫情嚴峻的挑戰下,各國無不卯足全力應戰,本院基因體研究中心即時運用所建立的技術平台及研發策略,應用到對抗病毒的預防和治療的研發工作,期望能以最快速度因應這嚴重威脅人類健康的傳染病。
【新冠肺炎的預防】
•白扁豆萃取蛋白可阻斷新冠病毒入侵
由本院基因體研究中心馬徹研究員及詹家琮研究技師合作的研究團隊發現《本草綱目》裡所記載的草藥-白扁豆萃取出的蛋白質Flt3 Receptor Interacting Lectin(FRIL),可以有效抑制流感病毒和新冠病毒(SARS-CoV-2)感染(圖1A)。
詹家琮研究技師由400多種中藥中發現白扁豆萃取物具有抑制流感病毒的功效,與研究疫苗抗體的馬徹研究員合作,經由一系列的純化工作(反覆的分離、比對、刪去),在白扁豆水溶液內發現一個凝集素(Lectin)具有抗流感病毒的性質FRIL。FRIL的結構如同一顆極小型的消波塊,約7奈米立方大小,該蛋白質具有4個完全一樣、向外突出的端點,而這4個端點在FRIL與周圍醣分子的鏈結作用扮演重要角色,此端點會抓住流感病毒表面上最重要的醣分子,使得流感病毒完全被抑制住而無法進入細胞,進而卡在細胞核外面無法完成複製。
在小鼠實驗模式中,研究團隊將FRIL噴入小鼠的鼻腔,在高度的H1N1流感病毒感染之下,七成有FRIL保護的小鼠相較對照組小鼠存活率明顯提升。進一步將FRIL與對多種流感有效的抗體F16做比較,FRIL可抑制更多種的流感病毒株且效力也更強。
已知新冠病毒SARS-CoV-2的棘蛋白也和流感病毒一樣,佈滿了complex type的醣分子,2020年4月研究團隊從疾管署拿到臺大醫院分離的病毒株後進行實驗,進一步測試FRIL對新冠病毒的抑制能力,在細胞實驗中發現只要極少量的FRIL,就可以與新冠病毒株hCoV-19/Taiwan/4/2020的棘蛋白結合,抑制新冠病毒感染細胞、阻斷其傳播,甚至在感染24小時以後再給予FRIL都有顯著的效果。此研究結果提供了新的抗疫研發方向,使得能以最快速度因應這個對人類健康產生重大威脅的傳染病。
•以老藥新用及中草藥對抗新冠病毒發現有效 抑制新冠病毒活性
翁啟惠特聘研究員的研究團隊分析「全球共享流感數據倡議組織(GISAID)」病毒基因資料庫,研究結果顯示在病毒棘蛋白1,273個氨基酸序列中,有超過1,000個氨基酸會產生突變。洪上程特聘研究員和翁啟惠特聘研究員即整合協調10多位研究人員團隊,收集現有市面上2,855個被核可使用的人類或動物用藥,運用高通量篩選設備,篩選出具有活性的潛力藥物。最初篩選出約30個具有良好抗病毒活性的藥物,經參照過往開發藥物的經驗,最後擇定具潛力的15個藥物,並由詹家琮研究技師主持的P3實驗室進行藥物抗病毒的細胞實驗,進一步準確測定抑制病毒之效果。
經由實際的細胞測試,發現靈芝、紫蘇、薄荷等藥材,即便稀釋100倍、都還是具有抑制病毒在細胞內複製的能力;且由敘利亞倉鼠動物實驗結果顯示抗瘧疾的藥物美爾奎寧(Mefloquine)以及薄荷萃取物具有最顯著的清除肺部病毒效果,而抗愛滋病之藥物奈非那韋(Nelfinavir)、靈芝萃取物RF3、紫蘇萃取物和薄荷萃取物也有顯著的可減少老鼠肺部的病毒量之活性,且不會影響體重(圖1B)。
翁啟惠特聘研究員表示,以目前的趨勢看來,COVID-19將來或許會演變成隨時會爆發的傳染病,再加上其快速的變種之特性,有必要發展廣效的疫苗以提供長遠的保護。而在藥物治療方面,除了持續研發更有效的藥物外,短期內可以篩檢已經在人體使用的藥物,找出對病毒有效的新用途。
【新冠肺炎的治療】
•簡化「新冠病毒」用藥「瑞德西韋」製程,為新型傳染病「立百病毒」的防禦做準備
COVID-19疫情在全世界已經延燒多時,且新的突變種持續出現,各國積極投入藥物開發。美國吉利德科學公司(Gilead Sciences, Inc.)研發的抗病毒藥物「瑞德西韋」,相繼獲得美國、日本和歐洲各國批准,成為全球第一個獲證用於治療「新冠肺炎」的藥物,臺灣食藥署也批准有條件上市。
由吉利德公司公布訊息指出「瑞德西韋」的製造成本高昂,故若能改良製程以降低成本,將能嘉惠更多需要使用「瑞德西韋」的患者。由洪上程特聘研究員和翁啟惠特聘研究員共同合作領導的研究團隊,運用結合不對稱催化和酸性去保護的「一鍋化」反應策略,針對吉利德在「瑞德西韋」合成方法中,最耗損材料之最後二項合成步驟,提出創新的製備方法,不僅省略中間一步的純化,減少矽膠和溶劑的使用,更大幅提高「瑞德西韋」的產率,有效降低製造的成本。
研究結果顯示這項「一鍋化」不對稱催化反應,不僅將原先一半必須廢棄的磷酸酯異構物,全數轉換成可供繼續反應的中間體,而且將合成「瑞德西韋」最後二步的總產率從48.3%提升到70%,加上回收的催化劑可以重複使用,應可大幅降低「瑞德西韋」的製造成本 (圖2A)。
•針對新冠肺炎病毒以及其變異株的單醣化棘 突蛋白疫苗
由於SARS-CoV-2變種能力超強,且傳播能力也隨之增強,還有可能大大影響現行疫苗效力。由野生型突變成D614到alpha、beta、gamma、delta及delta plus,時至今日雖已有許多COVID-19疫苗可供使用,但極有可能擺脫當前疫苗誘發的保護,讓已經接種疫苗的人仍然有再被感染的可能性。如何讓疫苗具備應付變種病毒的能力,產生完整的保護,是當前急需解決的難題。
棘突醣蛋白是所有新冠疫苗中最重要的蛋白質,並透過與人類ACE2受體結合進入細胞,而至今幾乎所有COVID-19疫苗所使用的抗原,皆以棘突蛋白為目標。由翁啟惠特聘研究員及馬徹研究員領軍之研究團隊,其研究結果顯示棘突蛋白表面醣基化程度很高,且聚醣覆蓋的抗原較少突變,故其所能誘發的免疫反應極具疫苗開發潛力。
研究團隊從發展廣效流感疫苗所累積的經驗著手,發現棘突蛋白表面醣化的多寡對病毒和抗體的結合力有重大的影響。若移除病毒表面上會干擾辨識的醣,露出更多可供辨認的特徵,就能夠讓疫苗增加更多的免疫反應,成為廣效抗新冠疫苗。
研究團隊運用專有的醣蛋白工程,移除疫苗棘突蛋白表面會干擾辨識的醣,開發出單醣化棘突蛋白疫苗Smg,透過小鼠動物模型驗證,結果顯示Smg疫苗比傳統疫苗可誘發2.1倍的IgG效價,並發現可以促進Th1細胞免疫反應,產生較高量的IFN-γ(圖2B)。且在輕症或是重症動物模型中,發現Smg蛋白疫苗不只在SARS-CoV-2原始株上提供更好保護之外,可維持小鼠的體重、增加存活率、降低肺部病毒量、並增加血清中中和抗體量。此外,研究團隊進一步研究此單醣化棘突蛋白疫苗對新冠病毒變異株之保護效力,利用感染D614G、alpha、beta、gamma突變株的動物模式進行試驗,發現接種Smg疫苗的小鼠,比接種傳統疫苗產生的IgG效價高出2倍至3.4倍(圖2B)。本研究所研發出之單醣化蛋白疫苗具有廣效的抗新冠病毒效果。
Figure legend
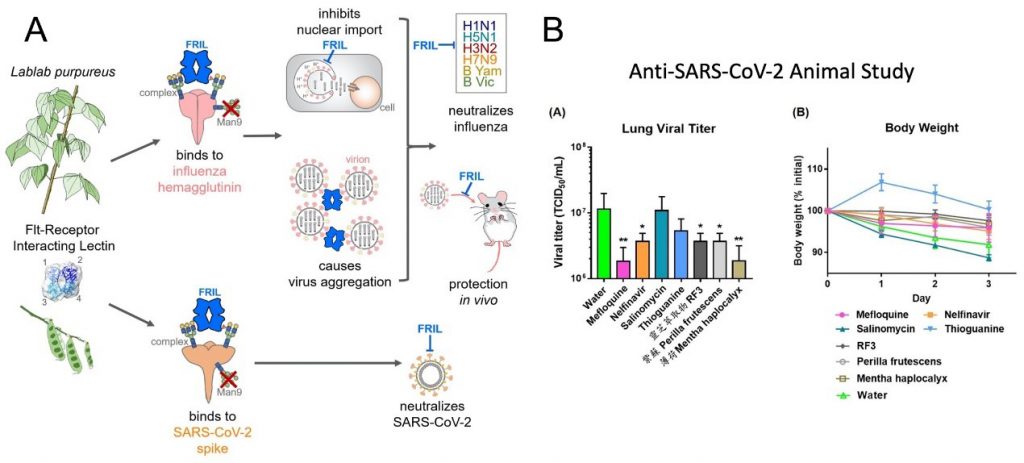
圖1A、白扁豆中萃取出來的FRIL蛋白,可以抑制多種流感病毒和新冠病毒;圖1B、倉鼠動物實驗驗證5種藥物可減少老鼠肺部的病毒量之活性,且不會造成體重減輕之副作用
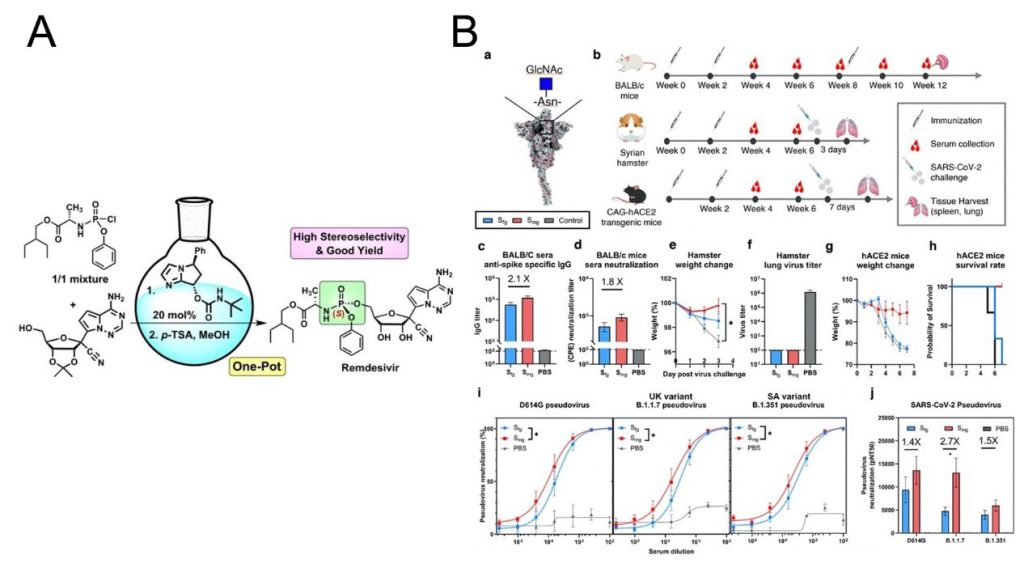
圖2A、結合不對稱催化和酸性去保護的「一鍋化」反應策略,大幅提高「瑞德西韋」的產率;,圖 2B caption: 以兩種動物模型實驗驗證Smg疫苗具有廣效的抗新冠病毒效果
參考文獻:
1.Liu YM; Shahed-Al-Mahmud M; Chen X; Chen TH; Liao KS; Lo JM; Wu YM; Ho MC; Wu CY; Wong CH; Jan JT; Ma C, A Carbohydrate-Binding Protein from the Edible Lablab Beans Effectively Blocks the Infections of Influenza Viruses and SARS-CoV-2. Cell Rep, 2020, 32(6), 108016.
2.Jan JT; Cheng TJR; Juang YP; Ma HH; Wu YT; Yang WB; Cheng CW; Chen X; Chou TH; Shie JJ; Cheng WC; Chein RJ; Mao SS; Liang PH; Ma C; Hung SC; Wong CH, Identification of existing pharmaceuticals and herbal medicines as inhibitors of SARS-CoV-2 infection. Proc Natl Acad Sci USA, 2021, 118 (5), e2021579118.
3.Daniel O’Day, 2020, 6.29, An Open Letter from Daniel O’Day, Chairman & CEO, Gilead Sciences. https://stories.gilead.com/articles/an-open-letter-from-daniel-oday-june-29
4.Gannedi V; Villuri, BK; Reddy SN; Ku CC; Wong CH; Hung SC, Practical Remdesivir Synthesis through One-Pot Organocatalyzed Asymmetric (S)-P-Phosphoramidation. J Org Chem, 2021, 86(7):4977-4985.
5.Liao HY; Huang HY; Chen X; Cheng CW; Wang SW; Shahed-Al-Mahmud M; Chen TH; Lo JM; Liu YM; Ma HH; Chang YH; Tsai CY; Huang PY; Chang SY; Chao TL; Kao HC; Tsai YM; Chen YH; Chen CY; Lee KC; Wu CY; Jan JT; Lin KI; Cheng TJR; Ma C; Wong CH, Impact of Glycosylation on SARS-CoV-2 Infection and Broadly Protective Vaccine Design. bioRxiv, 2021.05.25.445523.
