2020年襲捲全球的公衛危機,也就是冠狀病毒SARS-CoV-2引發的COVID-19疫情,截至2021年4月為止,已造成全球1.41億感染病例與301萬人死亡,造成了許多國家健康照護,甚至是社會、經濟多層次的嚴重衝擊。
然而,人體與動物體一生當中,其實無時無刻都要處理外來微生物的挑戰。微生物進入體內之後,不論是要消滅,或是要與之共存,生物體內的免疫系統的作用佔有著絕對重要的地位。譬如,當SARS-CoV-2病毒初次進入體內,首先會由先天免疫細胞(innate immune cells),包括嗜中性白血球(neutrophil)、巨噬細胞(macrophages)、樹突細胞(dendritic cells),以及先天性淋巴樣細胞(ILCs)與自然殺手細胞(NK cells)擔任起第一時間的病毒偵測及反應。而後天免疫細胞(adaptive immune cells)則會接著被活化,與先天免疫細胞一起清除病毒,並肩負形成免疫記憶的責任以提供長期的保護。
有鑑於COVID-19病患的臨床症狀從無症狀感染、輕微症狀到重症甚至死亡,嚴重程度相差甚多,各國的免疫科學團隊無不全力投入相關的研究,以期能建立病人對SARS-CoV-2反應的免疫圖譜,以利後續制定治療策略及疫苗的開發。本文將簡單敘述當前學界常用的新型研究工具,及這類技術如何應用於免疫相關議題的研究。
使用質譜流式細胞儀分析免疫細胞
人體一毫升的血液中,就含有4百萬至1千萬顆的白血球,廣義的來說這些都是免疫細胞。不論是臨床端或是實驗室端,都有賴快速實用的方法將這些免疫細胞做分類。不同功能與性質的免疫細胞,其細胞膜的表面蛋白表現量不同,藉由偵測這些特定的表面膜蛋白,就可以分析出血液中各種免疫細胞的組成。傳統上為了達到這個目的,實驗人員可以將有接有螢光物質的抗體和這些細胞做反應,細胞表面上的膜蛋白就可以被帶有螢光的抗體結合。之後,再將細胞一顆一顆的通過流式細胞儀(Flow cytometer),細胞通過雷射激發點時發射出來的螢光會可以被偵測並記錄訊號的強度,用以代表該抗體所標定的膜蛋白的表現量。
隨著對免疫系統的研究與了解,越來越多不同功能的免疫細胞被發現,相對應的也需要在單一免疫細胞上同時辨認更多種膜蛋白。然而,傳統流式細胞儀的限制就在於螢光物質發射波長頻譜,多有重疊之處。過多的螢光物質同時使用出現的話,互相重疊干擾問題無法避免,也就無法準確的分辨各種膜蛋白的表現量。因此,近年來有另一種新技術,稱為質譜流式細胞儀(Mass Cytometry, 或稱 Cytometry Time-Of-Flight, CyTOF),突破了螢光偵測的限制,以期達到同時偵測更多膜蛋白並更進一步細分免疫細胞的目的[參考資料1]。
質譜流式細胞儀的原理如圖A。首先,在質譜流式細胞儀的技術也同樣是透過抗原抗體的方法去偵測細胞的膜蛋白量,但在質譜流式細胞儀中,並不採用螢光物質標定抗體,而是利用各種稀有重金屬同位素,其原子量不同的特性加以標定抗體,就像傳統流式細胞儀,這些帶有稀有重金屬的抗體會和細胞表面的膜蛋白反應結合,之後再將細胞一顆一顆的送進質譜流式細胞儀做分析。在質譜儀中,每一顆細胞會在電漿中被汽化並分解為許多單一原子,這些單一原子(包含抗體上的稀有重金屬)就可以透過質譜儀加以偵測記錄下來。質譜儀記錄到每一顆細胞上,被標定的同位素金屬的種類與含量,就能轉換成每個細胞上該抗體標的蛋白的表現量。由於稀有重金屬同位素原子量固定,同時不會互相干擾,也就解決螢光頻譜會重疊的限制,因此可以同時用來標定抗體的稀有重金屬也就遠比可同時使用的螢光多。目前常使用於質譜流式細胞儀偵測的金屬,多屬於元素表上的鑭系金屬(lanthanide)與他們的同位素。若同時偵測45種金屬同位素,也就是偵測一顆細胞上45種蛋白質的表現量。
由於質譜流式細胞儀提供了過往流式細胞儀難以達到的細胞辨認的解析度,因此許多過往在流式細胞儀上被定義為是同類細胞或單一功能的細胞群,都還可以再被細分成不同功能群組出來。例如Amir Horowitz等科學家在2013年發表的研究中顯示,僅僅是自然殺手細胞,依照各種膜蛋白的表現量加以分群,每個人體內的自然殺手細胞推估會有高達6千至3萬種不同類型,不同人之間(即使是同卵雙胞胎)的自然殺手細胞類型,也有極大的不同。部分的類型取決於先天的基因型,但另一大部分則是受到後天的環境,例如和從小到大曾經經歷過的外來微生物挑戰有關[參考資料2]。
因此透過質譜流式細胞儀的分析,可對人的免疫系統有更進一步、更完整的了解。至於使用質譜流式細胞儀應用在COVID-19的研究上,Jonas Schulte-Schrepping 等人於2020年就利用質譜流式細胞儀發現COVID-19重症的病人,其免疫髓樣細胞(myeloid cells)會呈現特別的變化,而這種劇烈的免疫反應也跟疾病的嚴重程度息息相關[參考資料3]。本研究團隊目前也特別針對COVID-19病人的自然殺手細胞在感染期中的反應有著強烈的興趣,正透過質譜流式細胞儀的分析,試圖解開自然殺手細胞在病毒清除快與慢的病人內所參與的角色。
多層次免疫染色影像技術 (Multiplex imaging immunostaining)
在基因體及轉譯體研究都進到了高維度單細胞分析的年代之後,學界對於生物影像的高維度分析需求也日益增加。傳統光學免疫組織染色是透過使用接有螢光物質的抗體和組織切片做反應,藉由偵測螢光的分布,就可以得知相對應蛋白在組織上表現的位置及數量。如同流式細胞儀,這類以螢光為基礎的技術,會受制於不同螢光物質發射波長頻譜的重疊、干擾而無法達到同時偵測多種蛋白表現的目標。因此,類似上述質譜流式細胞儀的原理,也就被用來突破螢光頻譜的限制。依此概念發展出來的多層次離子束影像技術(Multiplex ion beam imaging, MIBI如圖B),就是使用稀有重金屬標定之抗體進行免疫組織染色,再透過離子束一點一點的掃描轟擊組織表面,每個點產生的包含抗體金屬在內的二次離子,經質譜儀分析,其金屬種類及量就可建構出二次離子質譜(Secondary ion mass spectrometry, SIMS)在此組織平面上的分布圖,進而轉換成該抗體標的蛋白在組織上的分布及表現量[參考資料4]。
目前,多層次離子束影像技術主要應用於研究腫瘤微環境中,免疫細胞及腫瘤細胞之間的相互作用,並透由相關的研究,進而開發新型癌症免疫療法或預測免疫治療的反應。本研究團隊目前也正利用此技術,試圖探討免疫治療無效之原因,並希望能開發出逆轉免疫細胞毒殺腫瘤能力下降的關鍵藥物。
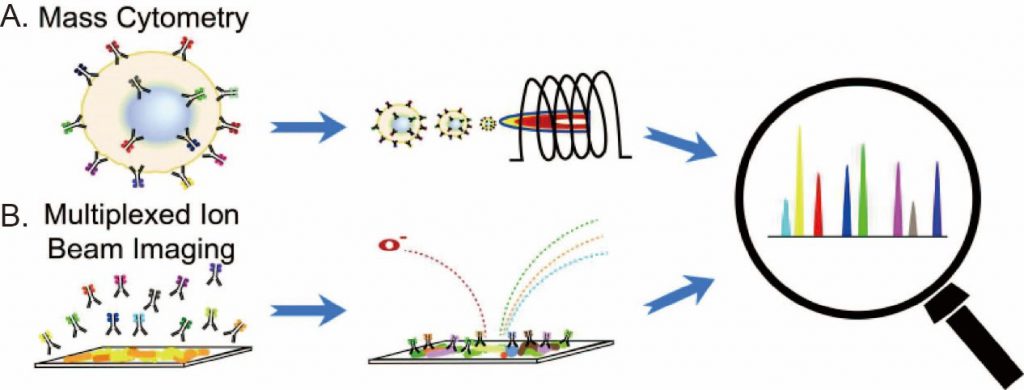
利用金屬標定抗體及質譜儀的方法進行單細胞蛋白表現分析之原理 A. 質譜流式細胞法 B. 多層次離子束影像技術
科技日新月異,過往僅能針對部分免疫細胞做出來的研究結論,目前都有機會透過利用高維度單細胞分析平台重新檢視。以上介紹應用稀有重金屬及質譜儀的質譜流式細胞儀及多層次免疫染色影像技術,就是在蛋白質體研究領域中很好的例子。同樣的在基因體、轉譯體的高維度單細胞分析研究工具上也都有長足的進展。
可以想見的,隨著這類分析平台的普及,大量高維度的資料將會陸續產生,故如何正確快速的對這類資料進行大數據分析,也會變成重要的課題。筆者相信,藉由跨領域的結合臨床端、檢測平台及資料分析等專業知識,我們更有機會針對單一個人或病人的免疫系統做更完整的了解,進而客製化訂制一系列適合獨特個體的健康方案或治療策略,達到促進群體健康的目標。
參考資料
1. Bendall SC et al. Single-cell mass cytometry of differential immune and drug responses across a human hematopoietic continuum. Science. 2011 May 6;332(6030):687-96. doi: 10.1126/science.1198704.
2. Horowitz A et al. Genetic and environmental determinants of human NK cell diversity revealed by mass cytometry. Sci Transl Med. 2013 Oct 23;5(208):208ra145. doi: 10.1126/scitranslmed.3006702.
3. Schulte-Schrepping J et al. Severe COVID-19 Is Marked by a Dysregulated Myeloid Cell Compartment. Cell. 2020 Sep 17;182(6):1419-1440.e23. doi: 10.1016/j.cell.2020.08.001.
4. Keren L et al. A Structured Tumor-Immune Microenvironment in Triple Negative Breast Cancer Revealed by Multiplexed Ion Beam Imaging. Cell. 2018 Sep 6;174(6):1373-1387.e19. doi: 10.1016/j.cell.2018.08.039.
