中研院新冠肺炎小分子藥物研發
世界衛生組織(WHO)秘書長譚德塞已在 3 月 11 號,宣布新型冠狀病毒疫情進入「全球大流行(pandemic)」,各科技大國正如火如荼地研發特效藥物。中研院生醫轉譯研究中心副主任謝興邦指出,院內已成立抗病毒小分子藥物研究小組,與國內各研究單位共創藥物資源共享平台,採取「老藥新用」策略,從健保學名藥下手,以期盡速找到有效藥物。
今年 (2020年) 2 月,中研院化學所陳榮傑副研究員團隊,成功合成「百毫克級」、純度達百分之 97 的瑞德西韋,且已精進到「公克級」、純度 99%。消息一出,引爆全臺熱議,因為瑞德西韋 (Remdesivir) 為當前最有希望對抗新冠肺炎的候選藥物。
根據 4 月 11 日「新英格蘭醫學期刊」(New England Journal of Medicine) 的最新研究,來自美國和全球的 53 名病患透過恩慈療法,接受瑞德西韋治療後,三分之二患者的病情獲得緩解,為全球衛生當局帶來正面消息,但仍需要等待控制安慰劑的雙盲試驗結果,才能確認瑞德西韋的療效。故此,全球科研單位皆同步尋找更多可能備選藥物,臺灣自不例外。
只是從零研發新藥緩不濟急,中研院新冠肺炎抗病毒小分子藥物小組召集人——謝興邦研究員兼副主任,擬定「老藥新用」、開發健保學名藥等策略,期待從過去藥物及時找到有效解方。今年 (2020 年) 4 月 10 日傳出初步捷報 ,生物化學研究所梁博煌研究員從上百種化合物中篩選出新冠病毒類蛋白酶抑制劑,已證實可在體外抑制新冠病毒複製。

中研院生醫轉譯研究中心謝興邦副主任,於本次中研院新冠肺炎抗病毒小分子藥物小組擔任召集人,擬定老藥新用、健保學名藥優先等重要策略。 攝影│林洵安
研發藥物,從靶點開始
不論從零開始或老藥新用,研發抗病毒藥物的關鍵為:找到抑制病毒複製的分子或化合物,作為藥物的原料—-先導藥物(lead compound)。但尋找先導藥物並非亂槍打鳥,一開始必須先選擇特定的「靶點」。
「靶點」,即是藥物分子作用的目標,通常是指以藥物干擾「病毒複製過程的某個階段」,目的是穩定、有效地壓制病毒。謝興邦比喻,病毒入侵細胞就像小編走進中研院生醫轉譯中心,必須通過層層關卡檢查。只要其中一道關卡擋住了,小編 (病毒) 就無法完成任務了。
從病毒複製過程,找出它的阿基里斯腱。
以新型冠狀病毒所屬的核糖核酸(ribonucleic acid, RNA)病毒來說,病毒藉由胞吞作用(endocytosis)進入細胞後,會先將自己分解、把遺傳物質(RNA)釋放出來,以利複製。接著,病毒會強迫宿主細胞的蛋白質合成系統,按照病毒信使 RNA(messenger RNA, mRNA),合成病毒複製所需的蛋白質「零件」與 RNA。這些蛋白質「零件」和 RNA 會重新組裝成數百個完整新病毒,最後離開宿主細胞。
靶點在哪?比方說:在病毒複製過程中,是由許多蛋白酶(enzyme)負責病毒蛋白質和 RNA 的合成、切割、重組等等工作。只要想辦法抑制這些蛋白酶的活性,就可以達到「卡關」的目的。一般來說,以欺敵戰略居多,也就是使用化學結構相似的分子來代替合成時所需要的「零件」,即有機會阻斷複製流程,而這些可被矇騙的蛋白酶就成為很好的靶點。
拿著名的候選藥物瑞德西韋而言,即以病毒 RNA 複製所需 RdRp 聚合酶(RNA-dependent RNA polymerase, RdRp)為靶點,用瑞德西韋的分子冒充病毒 RNA 的零件,欺騙 RdRp 聚合酶拿它去組裝新的 RNA,使組裝完成的 RNA 宛如被塞入異物的機器,無法發揮正常功能。
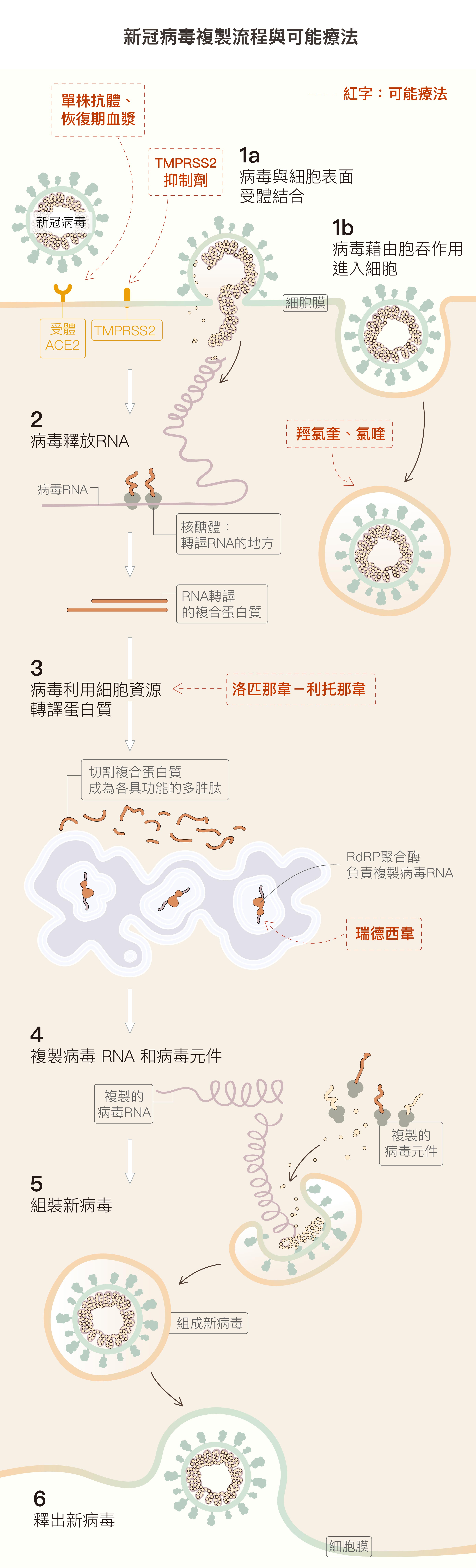
(1a)病毒棘蛋白與細胞表面受體 ACE2 結合,就像用鎖插入鑰匙開門,TMPRSS2 則會幫助病毒進入細胞。 (1b)細胞膜凹陷形成囊泡,把病毒包裹起來,進入細胞。 (2) 病毒進入細胞後會釋放遺傳物質 RNA ,並切斷 RNA 以利複製。 (3) 病毒綁架細胞的蛋白質合成系統,製造病毒複製所需各種多胜肽。 (4) 有些多胜肽負責複製病毒 RNA,有些複製病毒結構的「元件」。 (5) 將複製完成的 RNA 與結構元件,組合成一個個新病毒 。 (6) 新病毒離開宿主細胞。 資料來源│謝興邦 圖說重製│黃曉君、林洵安
新藥研發:十年磨一劍的高風險賭注
選定某個靶點後,研究者再以高速化合物篩選(high throughput screening)或 AI 虛擬藥物篩選,從茫茫化合物裡挑出幾種最具有潛力的先導藥物。先導藥物再經過一連串化學修飾與活性最佳化,並進行藥物動力學評估與疾病動物模型的確效評估,一步步走到候選藥物階段。簡言之,了解該藥物被活體吸收之後,在體內如何分布、代謝,以及是否能達到期望的效果等,再進入臨床「前」試驗。
臨床前實驗包括:透過白老鼠、狗、豬、猴子甚至猩猩,進行候選藥物之安全性評估,以了解藥物是否有潛在的副作用,更重要的是找到臨床起始安全劑量。此外,還要決定該藥物除了主成分,是否添加其他「賦形劑」,以及最終藥物呈現的形式—錠劑、膠囊、噴霧或針劑等等,才能到達最後關卡—人體臨床試驗。
藥物成功上市後獲利豐厚,但中途失敗,甚至一路過關斬將,卻在臨床實驗卡關的案例不可勝數。謝興邦提到:「在美國,一種藥物從製造到臨床實驗過關、經食品藥物管理局(food and drug administration, FDA)批准上市,一般需要耗時十到十二年,花費超過十億美金。」
