作者:廖仲麒研究員(本院原子與分子科學研究所)
動物細胞分裂的時候,有一組小的結構也會跟著細胞一起複製,再分到兩個細胞中。這一組小結構包含兩個圓柱形的結構,稱之為中心粒。為什麼需要這個中心粒跟著細胞一起分裂一起分配到兩個細胞呢?為什麼中心粒的形狀不是其他形狀而是很特別的柱狀結構呢?
近期的研究發現,中心粒除了跟著細胞分裂擔任拉著兩端DNA分開的工作之外,還負責了長一根叫做主纖毛的結構。這主纖毛的結構也是一個長的圓柱狀的結構,因此中心粒長成柱狀,事實上是負責這最重要的事情,也就是當作主纖毛的基底。主纖毛負責細胞的一些重要的感應,特別是上面有很多接受器可以偵測附近一些重要的分子,而進一步告訴細胞該做什麼。例如很重要的hedgehog signaling ,就是我們在發育的時候一個非常重要的,決定我們心臟長哪一邊,手指有幾根的重要調控。
這個主纖毛為了要做這樣的事情,必須控制主纖毛內部特殊的蛋白質的分佈,不該進去的蛋白質就不能進去這個主纖毛,而該進去的由主纖毛底部的結構調控,像一個守門員一樣。在這個主纖毛底部也就是在中心粒的最頂端,包含了非常多重要的蛋白質。這些蛋白質除了負責調控當守門員之外,另外也包含了把整根主纖毛支撐起來,以及擔任細胞中微管聚集的一個重要部位。從電子顯微鏡可以看到,在這中心粒頂部附近,有不少的微管直接貼在這個部分,也許在主纖毛內收到的資訊,可以迅速的經由這些微管聯絡細胞的各部分,讓細胞可以做全面性的反應。那麼,在這個主纖毛底部中心粒頂部,到底有哪些重要的結構及蛋白質呢?他們分別的功能又是什麼呢?他們的結構到底長什麼樣子呢?其實都是生物學家非常想要知道的。
在主纖毛底部有一個結構叫做過渡區,這個結構負責了上面所說的調控纖毛蛋白質進出的功能。在這個過渡區的部分,人們已經發現很多重要的蛋白質,包括數個與所謂的纖毛相關疾病ciliopathy有密切的關係的蛋白質,只要這邊的蛋白質有突變,就會造成嚴重的纖毛性疾病,病人常常較短壽或有嚴重的視力腎臟問題,因為纖毛主要的功能會被嚴重的破壞。在過渡區的下面有另外一個重要的結構,這個結構在電子顯微鏡下可以清楚的看到是9個輻射出去的短棒,這個結構叫做遠端附屬物。遠端附屬物的這9個像扇葉般的結構主要的功能就是連結纖毛底部的膜,支撐著整個主纖毛。
在這個遠端附屬物之下,另外還有一個結構,叫做次遠端附屬物。次遠端附屬物在電子顯微鏡下,看似幾個三角形的結構環繞在中心粒周圍,有時似乎有9個,有時似乎比較少。常常可以看到次遠端附屬物在它們三角形結構的尖端連結著微管。微管常常往外延伸,似乎有結構支撐和往外聯繫的功能。這些結構基本上雖然在電子顯微鏡下看得到,但是各自包含很多的蛋白質。一般沒有辦法清清楚楚的看出這些蛋白質它們的相對位置,因為這些結構基本上都圍繞在直徑大約180奈米的中心粒和主纖毛的周圍。以一般光學顯微鏡的解析度大約可以解析250奈米,在這個180奈米周圍大家的相對位置甚至小於100奈米,一般的光學顯微鏡是沒辦法分辨的。

圖一 次遠端附屬物的超高解析度影像,比例尺200奈米
所以應該怎麼辦才能看到他們這些蛋白質互相的位置,然後了解他們各自在那個位置可能的功能呢?從2001年開始,有幾個重要的光學突破,讓本來一般光學顯微鏡只能達到250奈米左右解析度的限制可以打破,其中包括Stefan Hell發明的STED超高解析度顯微術以及Eric Betzig發明的PALM超高解析度顯微術,將人類光學顯微鏡的解析度大幅提升。這些光學的突破讓許多本來不可能的結構解析變為可能,也因此獲得了2014年諾貝爾化學獎。STED巧妙地結合了兩個方法,其中一個是利用stimulated emission,也就是雷射LASER的SE,將分子從激發態強制釋放光子,讓分子還來不及釋放螢光前就回到基態,藉由濾片濾掉後這些分子看起來就是沒有螢光訊號的。另一個方法就是運用特殊的光學渦旋相位板,將此雷射的分佈轉為環狀的分佈,因此在環狀的區域大部分的分子沒有辦法釋放螢光,中間的區域仍然釋放螢光,也就是說,可以把兩個區域的分子其實在距離很近的狀況下分辨出來,達到超高解析度的顯微能力。控制雷射的強度下STED,可以達到50奈米的解析度,從原本一般顯微鏡的解析度大大的提升。
2006年發展的PALM和STORM兩種顯微術非常類似,基本上結合了三個方法:
(一)如果所有東西一起亮,全部黏在一起看不清楚,那就找一些特殊的閃動螢光分子,或加入特殊的化學溶液使螢光分子閃動,控制它閃動的頻率,讓它大部分的時候是暗的。也就是說,本來兩個很貼近的分子,如果一起亮分辨不出來,就控制它一個先亮,一個後亮。
(二)第二個方法就是,每一個亮點雖然它的大小還是大約250奈米,可是由於只是從一個光源出來的,基本上他的分佈應該是中間亮旁邊暗,如果光子的量夠,就可以用一個數學常態分佈的假設,猜測它中心的位置,準確決定光源是從哪一點來的。
(三)第三,再把上千張上萬張單一閃動的照片,全部疊加起來,每張照片都是超高解析度,疊加起來可以看到超高解析度的全景,PALM以目前的螢光分子亮度來說可以達到20奈米的解析度。STED和PALM兩種超高解析度都是非常巧妙的方法,突破了百年來光學解析的極限,讓生物學家進一大步的看到原本不能看到的生物分子結構。當然還有其他許多不同的超高解析度的方法,包括SIM、PAINT、 及擴展顯微術等,在此先不一一介紹。
我們的實驗室從2008年開始超高解析度顯微術的實驗,主要的生物題目就是了解主纖毛底部以及中心粒頂部,包括過渡區、遠端附屬物、及次遠端附屬物的結構,發表了3篇文章分別於 Scientific Reports、Nature Communications、及 eLife。在過渡區的部分,我們看清楚了哪些蛋白質比較靠近主纖毛中間類似鐵路軌道的部分,哪些蛋白質比較靠近外面纖毛膜的部分,可以了解哪些蛋白質是比較有可能擔任膜蛋白的控管,哪些蛋白質比較是負責把過渡區架在軌道上,使整個主纖毛研究的領域能夠更進一步的在結構上了解各蛋白質的功能,而不是之前十幾年來蛋白質都不清楚在哪裡,沒有結構認知,純粹基因方法研究猜測他們的位置。在遠端附屬物方面,我們把9個對稱的扇葉狀的結構上蛋白質的相對位置,弄清楚哪一個是比較靠近最尖端接觸纖毛膜的部分,哪一個是在最根部,讓所有的東西往上長的基底,哪一個是包覆在扇葉外面,讓這些遠端附屬物各自的蛋白位置與之前基因方法做出來的實驗做驗證。
除此之外,我們更了解其中某一蛋白能夠負責纖毛膜蛋白進出的控制,另外在9個對稱的扇葉狀結構之間發現其實是有物質存在的。以前認為這個部分沒有東西,但是我們發現這個結構是有調控的功能的,我們稱之為遠端附屬物matrix。這是一個新發現,是沒有超高解析度顯微術就沒有辦法辦到的。在次遠端附屬物方面,我們發現它們其實是比較不規則的幾個扇葉,這些扇葉沒有像遠端附屬物的結構這麼穩定,可以說比較軟一點,而且也不一定9個都會長出來,有時會少一些,長出來的角度也不見得都一樣。我們也一一解析在這次遠端附屬物上,各蛋白質的相對位置。更有趣的是,我們發現雖然遠端附屬物和次端附屬物負責的功能不同,一個管纖毛的成長、另外一個管微管網往外的延伸。但是我們發現它們的結構是息息相關的,把其中一個結構弄掉,另外一個結構就會有顯著的變化或是位置的改變。我們也清楚的看到將次遠端附屬物去掉,延伸出去的微管在這個附近就會減少,直接地證明了他們支撐微管的功能。
這一系列三篇超高解析度顯微術的研究,仔細的分析的這一個部分20種以上蛋白質的相對位置,讓我們對主纖毛和中心粒有更全面性以結構為基礎的了解,也讓生物學家能夠不用再瞎子摸象般地只用基因方法猜測各蛋白質的位置。還有非常多的生物結構等著用超高解析度顯微術觀察,而其實有可能在不久的將來,我們可以達到更高的解析度,建造結構生物學及細胞生物學之間的橋樑。
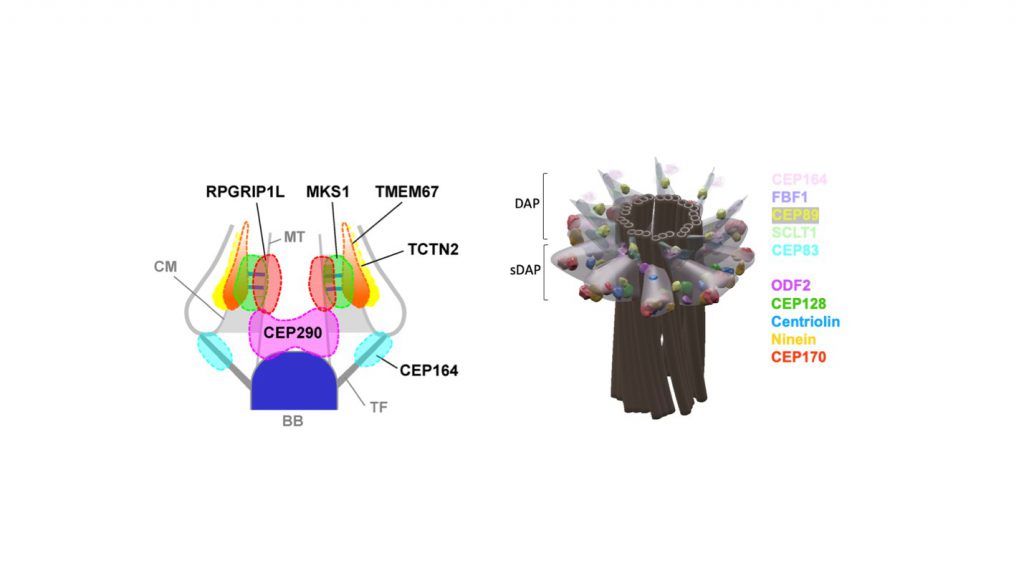
圖二 以STED超高解析度建構的主纖毛過渡區模型及以STORM超高解析度建構的中心粒遠端附屬物及次遠端附屬物模型
參考文獻
1. Chong, W.M., Wang, W.-J., Lo, C.-H., Chiu, T.-Y., Chang, T.-J., Liu, Y.-P., Tanos, B., Mazo, G., Tsou, M.-F.B., Jane, W.-N., Yang, TT., Liao, J.-C. (2020) Super-resolution microscopy reveals coupling between mammalian centriole subdistal appendages and distal appendages. eLife, 9, e53580.
2. Yang, TT., Chong, W.M., Wang, W.-J., Mazo G., Tanos, B., Chen, Z., Tran T.M.N., Chen, Y.-D., Weng, R.R., Huang, C.-E., Jane, W.-N. Tsou, M.-F.B., Liao, J.-C. (2018) Super-resolution architecture of mammalian centriole distal appendages reveals distinct blade and matrix functional components. Nature Communications, 9, 2023.
3. Yang, TT., Su, J., Wang, W.-J., Craige, B., Witman, G.B., Tsou, M.-F.B., Liao, J.-C. (2015) Superresolution pattern recognition reveals architectural map of the ciliary transition zone, Scientific Reports, 5, 14096.
