DNA是由四種核苷酸A、C、G、T所組成,這四個「密碼」的排列順序也蘊藏遺傳的訊息。這些訊息需先轉錄成RNA,再編輯轉譯成蛋白質,才能運作生命機制。過去相關研究在討論基因突變的致病性時,未曾考慮過RNA編輯機制的影響。
本院基因體研究中心莊樹諄研究員團隊,將生物資訊結合大數據分析,探討「A-to-G RNA編輯(RNA editing)機制」與基因突變的關係,為病理基因體學(pathogenomics)提供一個新的思考角度:在判斷基因突變的危害性時,除了看DNA序列,也應考量RNA轉錄資料,才能更精確地評估。此研究已於今(2019)年9月發表於《基因體研究》(Genome Research)。

莊樹諄研究團隊(中為莊樹諄,右二為論文第一作者麥德倫)
莊樹諄表示,A-to-G RNA編輯機制的正常與否,和自閉症、癲癇及阿茲海默症等複雜的神經疾病密切相關,此研究結果將有助於瞭解相關疾病,可望減少探討基因突變時對其致病及危害程度的誤判,同時也解釋了病理基因體學的一大謎題:為何某些有害突變能在演化中保存至今。
「RNA編輯機制」 是豬隊友還是神救援?
基因突變即是基因中的A、C、G、T排列發生變異。如果某個位置本應是「A」,卻變成「G」,即是發生「A/G點突變」。如果突變發生在重要的基因位置,影響到後續產生的蛋白質功能,便會對生命體造成危害。
A-to-G RNA編輯機制 可以在DNA[1]轉錄成RNA時,將RNA中的「A」,轉換成「G」。莊樹諄因此好奇,這套機制對DNA上的A/G基因突變而言,究竟是提油救火的「豬隊友」,還是雪中送炭的「神救援」?他大膽假設:A-to-G RNA編輯機制,可使某些A/G點突變的危害性下降。
研究團隊首先整合了447位不同人類個體的DNA及RNA序列資料,進行大數據統計與演化分析,並評估A/G點突變的危害程度、在群體中的發生頻率,及其與A-to-G RNA編輯機制間的關係。接著,再深入分析「千人基因體計劃」(1000 Genomes Project)蒐集到逾2000人的DNA序列資料後證實:A-to-G RNA編輯事件確實和A、G兩種核苷酸的發生率有關,尤其當A/G點突變所造成的危害越大,相關性就越大。
RNA編輯機制與基因突變的關係
分析結果顯示,基因突變危害的程度跟A-to-G RNA編輯機制密切相關:
一、 當A突變成G(A→G)有害時,A-to-G RNA編輯機制便會受到抑制;而當G→A突變有害時,該機制的發生率則明顯提高。
二、 當A→G突變越有害,該突變的所佔比率就越低;而當G→A突變越有害,G→A所佔比率則越高(圖A)。
三、 經由A-to-G RNA編輯機制的辨識序列 (ADAR motif)[2]分析顯示,若G→A突變發生在DNA的位點越重要,亦即該突變的危害程度越大,則該點發生A-to-G RNA編輯機制的可能性也會越高(圖B)。
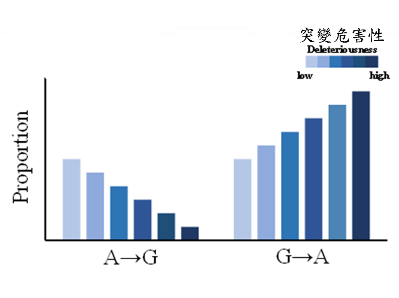
圖A:當錯義突變越是有害時,A→G突變所佔比率越低,而G→A突變所佔比率則越高
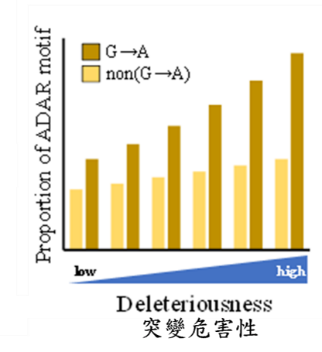
圖B:A-to-G RNA編輯機制的辨識序列(ADAR motif)出現率和突變危害程度的比較。
從以上結果可推測,人體會透過調控A-to-G RNA編輯機制,來平衡基因突變造成的危害。當A→G突變對生命有害時,生命體就降低A-to-G RNA編輯機制發生率,以減少A變成G;相反地,如果造成危害的是G→A突變,A-to-G RNA編輯機制就可能會「神救援」,把原本有害的A,回復為G。
莊樹諄表示,本次研究成果有賴大數據、生物資訊與堅實的演算邏輯推導(圖C)。在人類DNA序列上30億個鹼基被解碼之後,科學家得以藉此探索人體內各種生命機制的變化與DNA之間的關係。近年來個人化全基因體定序分析越來越普遍。這些大量且多樣的定序資料,若經過大數據的處理,可以協助醫療診斷的判讀,因此,生物資訊分析愈形重要。
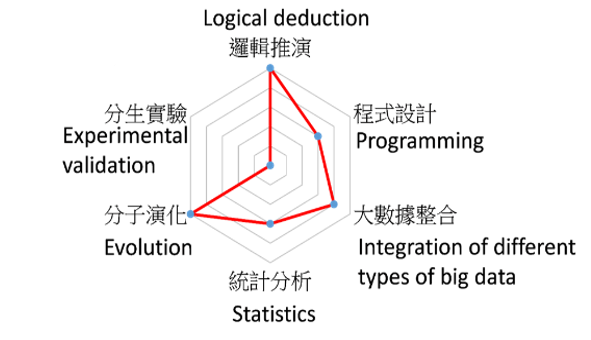
本研究所需的知識背景雷達圖。目前該研究團隊中有一半是「純理工」背景,另一半是「純分子生物」背景,一個理想的生物資訊團隊極需要上述兩種背景的同仁緊密合作。歡迎具備上述任一背景的同學加入嶄新的生物資訊世界。
本論文第一作者為基因體研究中心麥德倫博士。論文全文詳見:https://genome.cshlp.org/content/early/2019/09/12/gr.246033.118.full.pdf+html
(基因體研究中心)
[1] A-to-G RNA編輯事件常見於多細胞生物,其功能造成的影響是好是壞在學界仍有爭議。它一方面有機會增加序列多樣性,讓蛋白質產生新功能,另一方面也可能使蛋白質功能受損而導致「錯義突變」。許多研究顯示,這個機制的失調和自閉症、肌萎縮側索硬化症、顛癇、阿茲海默症等神經疾病有關。莊樹諄團隊除了開發新的A-to-G RNA編輯事件尋找方法(ICARES)之外,也對A-to-G RNA編輯事件在不同多細胞動物間做了廣泛的探討(詳見2018年發表在Genome Biology and Evolution的論文:https://academic.oup.com/gbe/article/10/2/521/4774976)。
[2] A-to-G RNA編輯機制是透過「ADAR蛋白質」得以運作,而本分析即是透過ADAR motif來預測A-to-G RNA編輯機制是否發生。
