衛福部最新資料顯示,癌症已連續36年蟬聯國人十大死因之首,隨著人平均壽命延長,癌症的發生率也逐年增加。除少部分遺傳性癌症外,大多數的癌症發生都是多因子造成,不當的生活型態與飲食習慣皆會增加罹癌風險。根據國外研究估計,肥胖與20%的癌症發生是有相關聯的 [1]。因癌症死亡的病人中,也有20%的女性及14%的男性與肥胖有關 [2]。
目前乳癌為我國女性好發癌症排名第一位,死亡率則為第四位。隨著生活型態及飲食習慣西化的改變,臺灣乳癌患者一方面平均年齡逐漸年長,但另一方面仍有不少年輕患者,好發年齡比歐美國家年輕十歲,約在45-64歲之間,以45-49歲每10萬名婦女發生213人為最高,其次為50-64歲的210-205人次之。許多研究顯示,女性的肥胖與乳癌「惡化程度」(malignancy)之間存有某種關係,肥胖會增加停經後女性20-40%罹患乳癌風險 [3]。而且不論停經與否,肥胖也是乳癌復發及死亡的不良預後因子。在一項統計中,BMI>40kg/m²的重度肥胖者,乳癌死亡率是BMI<20.5kg/m²纖瘦者的3倍 [4],但箇中原因仍無法證實。為了解釋這種現象,研究人員已從單純癌細胞的研究擴展到癌細胞所處環境影響的探討,即「腫瘤微環境」研究。癌細胞與其微環境之間的相互作用,包括癌細胞周邊的纖維母細胞、免疫細胞、脂肪細胞等,對於癌症的產生與發展過程,甚至遠端轉移皆扮演重要角色。若能了解腫瘤細胞與其微環境之間的交互作用,將可用於改善疾病診斷或作為發展新治療方法之基石。
乳房主要由乳腺、結締組織與脂肪組織所構成,而後者大部分則由脂肪細胞所組成。乳癌患者的脂肪細胞亦是助長乳癌細胞壯大的利器,乳房脂肪細胞不但能促進腫瘤的進展,也參與癌變(carcinogenesis)的初始階段,甚至對腫瘤治療的抗性(resistance)扮演重要角色。過去已有數個臨床研究指出,脂肪細胞可能透過分泌細胞激素如 Leptin和 IL-6 [5],進而促進乳癌的發展。另一方面,肥胖與雌激素受體 (estrogen receptor) 陽性之乳癌病人不良預後習習相關,尤以在停經後婦女更為顯著,因為脂肪組織為停經後婦女體內雌激素唯一來源 [6]。然而由於缺乏系統性的研究,乳癌細胞和其鄰近脂肪細胞的互動,是一個尚有許多未知數的研究領域,目前對於脂肪細胞是如何影響乳癌發展的明確分子機制(molecular mechanism),仍不甚明瞭。
藉由與臺大醫院的研究團隊合作,我們以乳癌病人檢體的脂肪組織作為研究對象,闡述了乳癌細胞與脂肪細胞互動的來龍去脈 [7]。我們將乳癌腫瘤切除樣本分離出來的脂肪細胞,稱為乳腺來源脂肪細胞(mammary gland-derived adipocytes, MGDAs),將之與不同乳癌細胞進行共同培養(co-culture),希望找出參與乳癌細胞與脂肪細胞互動的全新接受體(novel receptor)。經由乳癌細胞株全基因圖譜分析並搭配文獻瀏覽,我們首先找出16個編譯乳癌細胞膜或細胞膜相關蛋白的基因可能參與MGDAs互動。並利用核糖核酸干擾(RNAi)去除技術(knockdown)進一步交叉比對分析,以期找出何者能促進腫瘤細胞增長。
經過反覆驗證,最後找出一個表現於乳癌細胞膜上,同時在脂肪細胞互動上扮演重要角色的基因,名為“第二型單羧酸轉運蛋白”(monocarboxylate transporter 2, MCT2)。MCT2蛋白主要功能在於傳遞,就像一個閘口位於乳癌細胞膜上,運輸多種單羧機酸(monocarboxy licacid),主要為丙酮酸(pyruvate)、乳酸(lactate)、ß-羥基丁酸(ß-hydroxybutyrate, ß-HB),將這些小分子由胞外區域帶進細胞內。MCT2在乳癌細胞上的表現明顯高於正常乳腺細胞,在與病人臨床資料結合分析後,進一步發現,無論年齡、腫瘤大小、淋巴結轉移或是雌激素受體陽性與否,MCT2的高度表現是一個獨立的乳癌不良預後因子。另外我們也觀察到MGDAs中的ß-HB分泌量明顯高於其他乳房基質(stromal vascular fraction, SVF)細胞,利用RNAi knockdown技術比對各種乳癌細胞株,發現只有ß-HB可以明顯促進MCT2高度表現的乳癌細胞的增長。此外,進一步小鼠實驗中也驗證,MGDAs可透過分泌ß-HB促進帶有高度表現MCT2的乳癌腫瘤增生。
ß-HB是一個已知的組蛋白去乙醯酶(histone deacetylases, HDACs)內生性抑制劑 [8]。也就是說,將細胞以ß-HB處理,會增加組蛋白乙醯化(histone acetylation),導致基因活化。這給了研究者一個新的研究方向,ß-HB是否藉由表觀遺傳方式(epigenetics)調控染色質(chromatin),讓該染色質上的腫瘤促進基因(tumor-promoting gene)活化?我們利用染色質免疫沉澱(chromatin immunoprecipitation)分析,發現MCT2 表現之乳癌細胞接受到脂肪細胞分泌之ß-HB後,可有效增加組蛋白H3K9位置的乙醯化並誘導產生許多與促進癌細胞生長相關之因子表現,例如細胞激素 IL1β 與脂肪素 LCN2,最後促進腫瘤增生。同時,我們也觀察到在乳癌臨床檢體中,MCT2表現量與 IL1β 及 LCN2表現量具有高度正相關,並顯示較差預後。於是,一個全新的,有關脂肪細胞與乳癌進展交互作用的分子機制由此被發現:乳腺來源脂肪細胞分泌ß-羥基丁酸(ß-HB),經由旁分泌(paracrine)方式,傳送到細胞膜表面帶有MCT2蛋白的乳癌細胞內。在細胞內經由表觀遺傳調控乙醯化組蛋白H3K9,使腫瘤促進基因IL-1ß, LCN2活化,達成腫瘤進展的目的(圖1)。
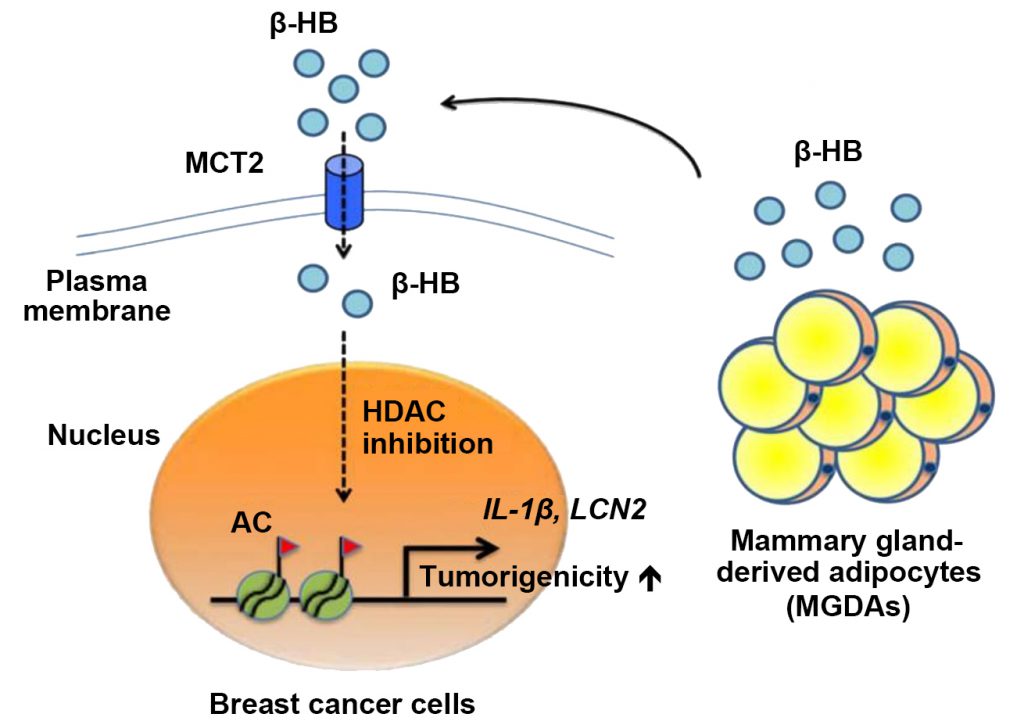
圖1:MGDAs分泌ß-HB,經由旁分泌(paracrine)方式,傳送到細胞膜表面帶有MCT2 蛋白的乳癌細胞內。在細胞內經由表觀遺傳調控乙醯化組蛋白H3K9,使腫瘤促進基因IL-1ß, LCN2活化,達成腫瘤進展 [7]。
總結來說,當乳癌細胞所在的環境內有很多脂肪細胞的存在時,乳癌細胞上MCT2存在與否決定了乳癌細胞對其微環境中脂肪細胞的反應。藉由MCT2吸收源源不斷的β-HB,進而促成乳癌細胞的增生,以MCT2做為生物標記和做為標的進行治療或許可成為乳癌治療的另一道曙光!除此之外,也可藉由規律的生活與飲食習慣減少肥胖的產生,並配合有氧運動,讓脂肪細胞多多參與有氧代謝,進而減少癌細胞的養分,達到抑制腫瘤增生的效果,以達到乳癌治療與預防的契機。
參考資料
- Wolin KY, Carson K, and Colditz GA. Obesity and cancer. Oncologist. 2010;15(6):556-65.
- Calle EE, Rodriguez C, Walker-Thurmond K, and Thun MJ. Overweight, obesity, and mortality from cancer in a prospectively studied cohort of U.S. adults. N Engl J Med. 2003 Apr 24;348(17):1625-38.
- Munsell MF, Sprague BL, Berry DA, Chisholm G, and Trentham-Dietz A. Body mass index and breast cancer risk according to postmenopausal estrogen-progestin use and hormone receptor status. Epidemiol Rev. 2014;36:114-36.
- Petrelli JM, Calle EE, Rodriguez C, and Thun MJ. Body mass index, height, and postmenopausal breast cancer mortality in a prospective cohort of US women. Cancer Causes Control. 2002 May;13(4):325-32.
- Vona-Davis L and Rose DP. Adipokines as endocrine, paracrine, and autocrine factors in breast cancer risk and progression. Endocr Relat Cancer. 2007 Jun;14(2):189-206.
- Cleary MP, and Grossmann ME. Minireview: Obesity and breast cancer: the estrogen connection. Endocrinology. 2009 Jun;150(6):2537-42.
- Huang CK, Chang PH, Kuo WH, Chen CL, Jeng YM, Chang KJ, Shew JY, Hu CM, and Lee WH. Adipocytes promote malignant growth of breast tumours with monocarboxylate transporter 2 expression via beta-hydroxybutyrate. Nat Commun. 2017 Mar 10;8:14706.
- Shimazu T, Hirschey MD, Newman J, He W, Shirakawa K, Le Moan N, Grueter CA, Lim H, Saunders LR, Stevens RD, Newgard CB, Farese RV Jr, de Cabo R, Ulrich S, Akassoglou K, and Verdin E. Suppression of oxidative stress by β-hydroxybutyrate, an endogenous histone deacetylase inhibitor. Science. 2013 Jan 11;339(6116):211-4.
