作者 / 陳志成/生物醫學科學研究所研究員
摘要
幾乎每個人都會有痠痛的困擾,但,痠痛感覺如何產生與傳遞?痠痛是由酸所引起的嗎?酸一定會引起疼痛嗎?痠痛是痠還是痛?如何能阻斷痠痛?這些看似簡單的問題,即使對疼痛科醫師或是疼痛專家來說,也沒有肯定的答案。臨床上,痠痛似乎與組織酸化習習相關。然而,最新的研究發現,肌肉組織酸化不但能誘發疼痛反應,亦會產生止痛訊息。在痛覺神經上,的確有許多不同類別的酸敏性受體膜蛋白,而這些酸敏性受體膜蛋白可能就是傳遞痠痛或止痛訊息的關鍵因子。提供了我們一窺痠痛奧秘的機會。
前言
痠痛對許多慢性疼痛的病人是長期的折磨,特別是纖維肌痛症、肌筋膜疼痛、關節炎、或下背痛的患者。健保署統計、2017年高診次民眾就醫疾病、第一名為下背及肌肉軟組織痛、共五十七萬三千件、醫療費用約四億九千萬元。然而,目前止痛藥物或物理治療仍然無法有效處理痠痛的問題。
組織酸化與疼痛
痠痛很容易聯想到組織酸化(造成氫離子濃度的增加):當組織受傷、缺血、發炎,會產生組織酸化並伴隨著疼痛。臨床上的觀察,許多疼痛都與組織酸化相關。像是激烈運動後的肌肉痠痛、關節發炎所誘發的疼痛、肌筋膜疼痛、心絞痛、等等。然而,直到1996年德國科學家才首次建立組織酸化與疼痛的因果關係。後續許多臨床研究,也證明組織酸化的確會誘發疼痛。然而,酸是透過什麼樣的分子機制來刺激痛覺神經,卻一直沒有定論。再者,酸所誘發的疼痛,是否就是我們慣稱的痠痛?目前也還無法證實。
酸敏性受體膜蛋白
我們人體身上各個組織都佈滿著痛覺神經、上面有許多可被酸給激活的離子通道或受體分子。早在1980年代初期,烏克蘭科學家Kristal 利用細胞電生理的方法,首次發現酸可以激活感覺神經細胞,使其產生電流並誘發動作電位。後續許多研究發現,痛覺神經細胞對酸的刺激是相當敏感的,因而提供了酸可誘發疼痛的一個重要的神經生物學基礎。在分子的層面上,目前已知有四大類的受體膜蛋白表現在痛覺神經元上:分別是(一)酸敏性離子通道(ASIC);(二)辣椒素受體蛋白;(三)酸敏性G蛋白耦和受體;(四)雙孔鉀離子通道(圖一)。其中,酸敏性離子通道因大量表現在痛覺神經細胞上,相較于其他酸敏性受體膜蛋白,對酸亦相對敏感,因而最受矚目。酸敏性離子通道在1996年被發現,已知有六個亞型,分別為:ASIC1a, ASIC1b, ASIC2a, ASIC2b, ASIC3, ASIC4。一個完整的酸敏性離子通道需由三個單體組成:可以是三個相同或不同ASIC亞型的組合。依據所組成的ASIC亞型,酸敏性離子通道對組織酸化的敏感度可從接近生理的酸鹼值(~pH7.2) 到非常嚴重的組織酸化(≤pH5.0)。因此,不同的感覺神經纖維會因組織分佈的不同,而配備不同酸敏感度的酸敏性離子通道。例如,分佈于肌肉的痛覺神經纖維,大都表現ASIC3亞型,這是所有ASIC亞型中,對酸敏感度最好的(pH0.5=6.7)。許多動物實驗亦證實,肌肉痛覺神經的ASIC3是酸可誘發慢性疼痛的主要因子。在慢性疼痛的動物模式中(例如肌肉軟組織組織發炎、術後疼痛、肌肉痠痛),抑制ASIC3或將之基因剔除後,可完全阻止酸所誘發的慢性疼痛。
慢性疼痛的形成
動物實驗的結果顯示,上述這些酸敏性受體膜蛋白與疼痛的關係非常密切。舉纖維肌痛症動物模式為例,在實驗小鼠單側腓腸肌內注射pH4.0生理食鹽水後,會在同側與對側的腓腸肌以及後肢腳掌,均誘發機械性疼痛過敏化現象;意即誘發了原發性疼痛過敏化 (primary hyperalgesia)、續發性疼痛過敏化 (secondary hyperalgesia)、與鏡像疼痛 (mirror imaging pain)。雖然這種肌肉內組織酸化所誘發的疼痛過敏化現象僅持續幾個小時,假如五天內在同一位置注射同一劑量的酸性生理食鹽水,就會誘發慢性疼痛過敏化,並持續四周左右。這個纖維肌痛症實驗模式提供了一個平台,來驗證組織酸化是如何誘發慢性肌肉疼痛,以及各種酸敏性受體蛋白在這過程中所扮演的角色。上述提到ASIC3就是其中最重要的一個關鍵分子。當ASIC3基因剔除後,實驗小鼠完全不會對肌肉組織酸化有疼痛反應。辣椒素受體蛋白(TRPV1)是另一個重要分子。當TRPV1基因剔除後,肌肉組織酸化仍會誘發疼痛過敏化,但僅能持續幾個小時,無法誘發慢性疼痛。在肌肉組織酸化的實驗,假如同時以藥物來抑制ASIC3 (如:海葵毒素APETx2)或是TRPV1(如:辣椒平capsazepine),五天後再次的肌肉酸化刺激就僅能誘發短暫的疼痛過敏化現象,而無法誘發慢性疼痛。但是,如果再次的肌肉酸化刺激發生于第二天,仍會誘發7~10天的疼痛過敏化現象。因此,我們可推論出,第一次肌肉組織酸化不僅是誘發了短暫的疼痛過敏化現象、亦讓肌肉痛覺神經產生了可塑性變化。因此,五天以內的再次肌肉酸化刺激,就足以發展成慢性疼痛。顯然,刺激ASIC3 與TRPV1 都會造成肌肉痛覺神經的可塑性變化。 在肌肉酸化的實驗中,若同時抑制ASIC3 與TRPV1 這兩個膜蛋白分子,即可抑制酸所誘發的疼痛過敏化現象。有趣的是,這樣的實驗小鼠對第二天再次的肌肉酸化刺激,竟完全沒疼痛反應!我們可從這個實驗結果得知:除了ASIC3 與TRPV1 之外,還有一個未知、但是很重要的酸敏性受體分子參與了肌肉酸化過程中,慢性疼痛的誘導。而這是一個可以止痛的酸敏性受體分子!
酸的止痛作用
在這個纖維肌痛症動物模式中所發現的“酸止痛”作用似乎顛覆了大家傳統對“痠痛”的想法。我們進一步發現,“酸止痛”作用是透過一種叫物質P (Substance P) 的神經傳導物質來執行。物質P是一種存在痛覺神經末梢的重要神經傳導物質,當痛覺神經被刺激後,在脊髓端的神經末梢會釋放物質P,而促進中樞神經的致敏化,以誘發疼痛。然而,物質P從肌肉端的神經末梢釋放後,可激活痛覺神經上的鉀離子通道,因而抑制神經活性,來達成止痛作用。當肌肉酸化時,酸可激活俱有ASIC3 或TRPV1的痛覺神經,造成疼痛過敏化與神經可塑性變化; 同時亦激活俱有“酸止痛”能力的神經釋放物質P,以抑制疼痛(圖二)。物質P在肌肉中,似乎扮演著煞車的角色。當肌肉酸化發生時,疼痛與止痛的訊息同時被啟動,因此大部分情況下,酸僅會誘發短暫的疼痛過敏化現象; 需要重複的肌肉酸化刺激痛覺神經,才會發展為慢性疼痛,而且這慢性疼痛是可控制的,持續約一個月時間。然而,當我們抑制了物質P這個煞車系統,一次肌肉組織酸化的刺激就足以誘發慢性疼痛。而且,這樣的慢性疼痛會變得無法控制,實驗小鼠會一直痛下去。
這個“酸止痛”作用似乎是許多慢性疼痛的答案,提供了止痛藥開發的新方向。這也許可以解釋為甚麼有些慢性疼痛一旦被誘發,就變成頑抗型的疼痛。
痠或痛?
既然酸(氫離子)可以誘發疼痛、又可止痛,那麼臨床上,痠痛病人到底是抱怨痠還是痛?在中文的概念,痠痛通常是被同時提起。因此,疼痛科醫師在處理病人的慢性疼痛,是沒有分別痠與痛的。在英文的書寫中,雖然有soreness代表“痠”,臨床上亦是當成pain (痛) 來處理。而且,國際疼痛研究協會(International Association for the Study of Pain) 所列舉的疼痛名詞中,並沒有soreness這個字。然而,從我們自身的經驗、社群的討論、以及臨床的初步觀察,九成以上的國人都可以很清楚地說出痠與痛的差別!或許,在華人文化中,因為語言與文字的使用習慣,我們比較能夠理解痠與痛的差別。許多頑抗型的慢性疼痛,或許不僅有痛的成分、還有痠的問題需要被理解與處理。把痠與痛當成兩種不同慢性疼痛的症狀,未來或許比較容易開發更具專一性的止痛藥物,以解決慢性疼痛之苦。
結語
痠痛是一個重要的醫學問題,成因相當複雜。因為組織酸化不僅能誘發疼痛,亦可產生止痛訊息,它與痠痛之間是否存在著因果關係仍未有定論。未來的研究方向需要將痠與痛視為兩種不同的臨床症狀,並且探討背後的分子病理機制,以期能啟發並幫助新一代止痛藥物的開發。
深入閱讀
1. Lin CCJ, Chen WN, Chen CJ, Lin YW, Zimmer A, Chen CC* (2012) An antinociceptive role for substance P in acid-induced chronic muscle pain. Proc Natl Acad Sci USA 109: E76-E83
2. Chen WN, Chen CC* (2014) Acid mediates a prolonged antinociception via substance P signaling in acid-induced chronic widespread pain. Mol Pain 10: 30
3. Sun WH, Chen CC* (2016) Roles of Proton-Sensing Receptors in the Transition from Acute to Chronic Pain. J Dent Res 95(2): 135-142.
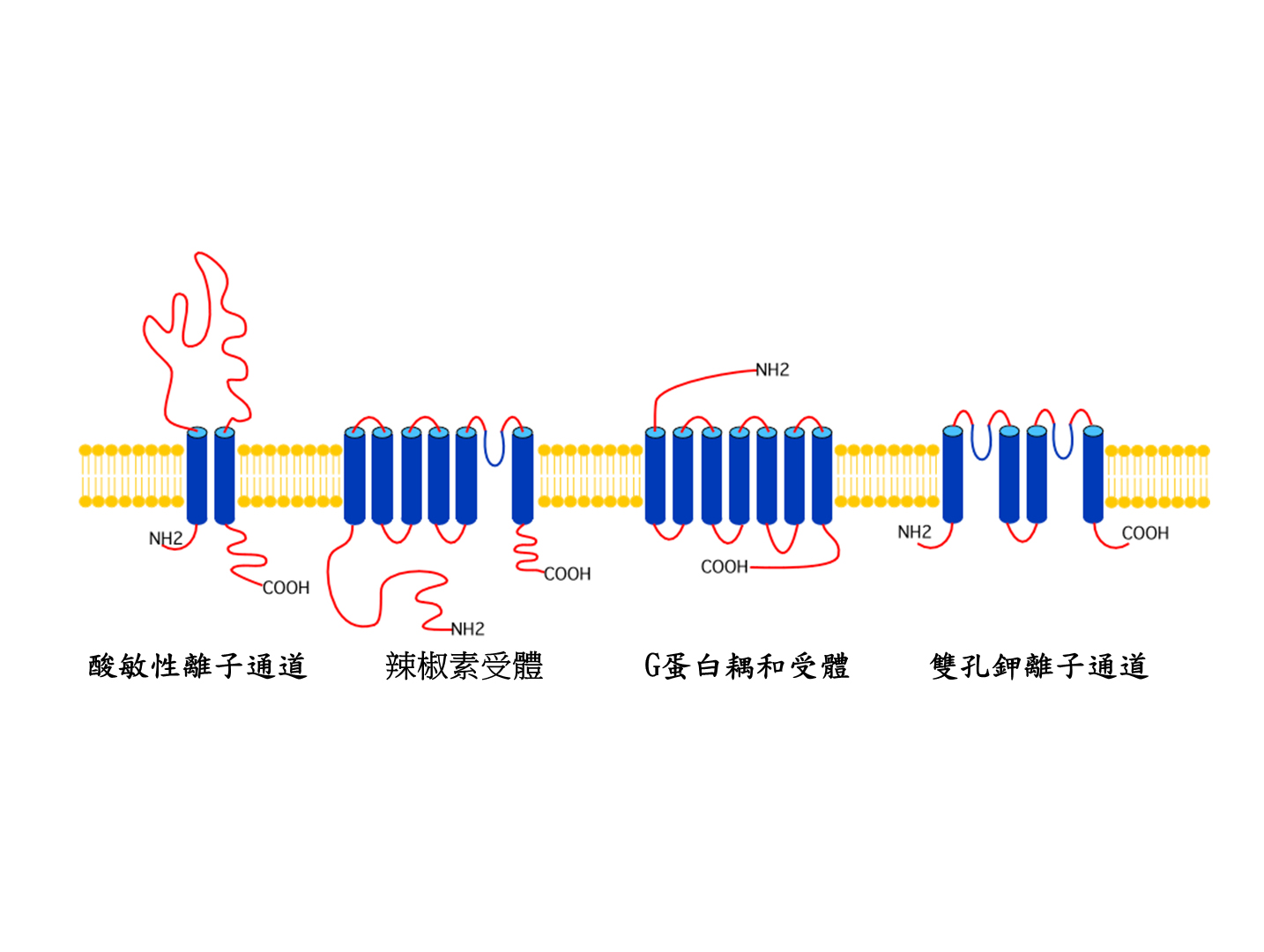
圖一:痛覺神經上的四大類酸敏性受體膜蛋白
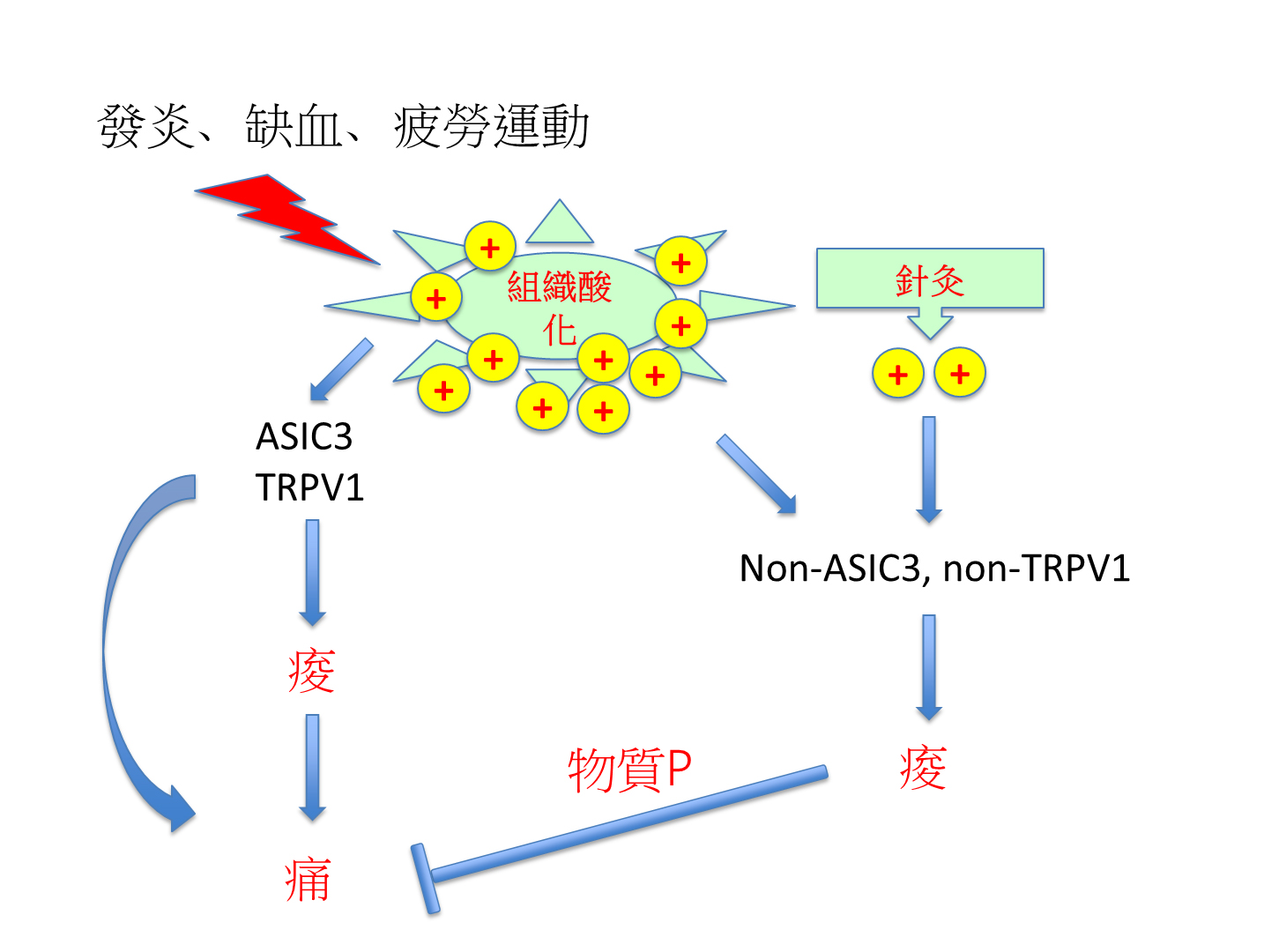
圖二:酸的致痛與止痛訊息
