
人類自一萬兩千年前開始馴化、選擇適合栽培的糧食作物,並且透過戰爭、部落遷徙以及商業行為,尋找更合適的栽培環境與改良更符合食用價值的品種。至今,為了因應環境變遷與食用喜好,人類仍然持續著馴化、引種、選育更適合栽培與商業需求的新品種來解決人類吃的問題。
聯合國氣候變遷專門委員會(IPCC)第六次評估報告中提出,隨著全球暖化,預估約有 33-36 億人口生活在極易受氣候變化影響的環境中,生態平衡與糧食供需都將受到威脅 1。過去為了挑選適應環境或符合市場取向的品種,利用人工授粉等育種的技術將優良特徵逐步改善,經過數代的人為選擇,可以獲得帶有目標特徵的新品種。這樣的選育流程通常需要耗費作物 6-7 個世代才能讓一個目標特徵穩定遺傳,可能需要花費數年甚至數十年才將多個特徵同時加到到新品種上,這也意味著如何開發新的技術來加速育種的工作,以快速因應環境變遷與市場喜好的變化是一個重要的課題。
新型態基因編輯技術CRISPRC/Cas 加速植物分子育種腳步
過去十年,研究人員利用基因編輯技術來「增加、刪除或改變」生物的 DNA 序列,使得基因編輯在 1-2 個世代就能達到類似自然界演化、基因突變或是雜交的目的,這些技術讓生物學發生了巨大的變化。CRISPR/Cas(Clustered Regularly Interspaced Short Palindromic Repeats/CRISPR-associated proteins,常間回文重複序列叢集/常間回文重複序列叢集關聯蛋白系統)基因工程系統的建立,啟發了生物學家無限的創造力。受自然界存在的 CRISPR/Cas 蛋白啟發,其簡便的設計和易於傳送到細胞中的特點,促使科學家不斷開發具有不同功能的 CRISPR/Cas 蛋白質來精確切割和粘貼 DNA。
CRISPR/Cas 蛋白是一種 DNA 剪切酶,可以和引導 RNA 結合成複合體,並搜索染色體上與 RNA 序列互補的目標 DNA(找到想改變的基因位置),精準剪切編輯 DNA 序列(不會影響到其他不想改變的地方)。在自然界,細菌為了抵禦嗜菌體這一類的病毒而發展出來的防禦機制。病毒入侵細菌後,利用細菌體內的原料持續自我複製,最終導致細菌死亡。做為回應,一些細菌演化出反擊的手段,它們演化出 DNA 剪切酶,一旦發現有病毒基因入侵,就將其 DNA 切碎,當這些細菌在病毒攻擊中倖存下來後,它們會把病毒 DNA 的小片段嵌入自己的基因組建檔成資料庫,這些病毒代碼片段(將形成引導 RNA)使細菌記憶過去攻擊過自己的敵人。當病毒下次再攻擊時,細菌可以用一種更强大的剪切酶-CRISPR/Cas 蛋白有效率的瓦解病毒攻擊。
研究人員從自然界的啟發修改了 CRISPR/Cas 核酸剪切系統,研究人員應用這些蛋白質使用在基因編輯技術。Jennifer Anne Doudna 與 Emmanuelle Marie Charpentier 更因此技術的開發獲得 2020 年諾貝爾化學獎。現今最被廣泛應用在植物科學研究的是 CRISPR/Cas9 二聚體 DNA 剪切酶。
操作 CRISPR/Cas 基因編輯系統第一步是尋找目標基因上 CRISPR/Cas9 蛋白辨識位 PAM(protospacer adjacent motif)鄰近區域的 DNA 序列,並設計合成與 DNA 序列互補的單鏈引導 RNA(sgRNA),目標可以是細胞核染色體上的任一區域, 因此無論是生物的遺傳缺陷還是不受歡迎的特徵都可以進行剪切編輯。然後將這種極短序列的 sgRNA 與 Cas9 蛋白組合成 RNP 複合體(Ribonucleoprotein)後,進入目標編輯細胞中。RNP 複合體上的 CRISPR/Cas 搜索 PAM 區域,依據 sgRNA 的序列掃描染色體上可以配對的 DNA 序列後,CRISPR/Cas 二聚體蛋白就如同剪刀的兩片刀刃,將目標 DNA 位置剪斷。
被剪斷的 DNA 在自我修復過程中可能因為遺失小片段的 DNA,使得遺傳缺陷或是不受歡迎的特徵無法在下一代表現;或是在 DNA 自我修補的過程中尋找鄰近的 DNA 做為模板,在剪斷的切口中增加一段新的 DNA 序列並進而獲得新的遺傳特徵 2。
CRISPR/Cas 解決 GMO 法規限制與食用安全疑慮
雖然美國農業部已經准許少數基因改造農產品上市,但歐盟或亞洲國家的政策與消費族群對於染色體中含有外源物種 DNA 片段的基因改造作物仍然抱持著謹慎保守的態度。過去依賴農桿菌或基因槍導入外源物種 DNA 的基因改造作物雖然可以大幅縮短目標遺傳特徵累積所費時間,但其栽培環境受到非常嚴謹的法規監管,更遑論成為商業品種上市。CRISPR/Cas 基因編輯技術的成熟,且只針對特定的區域進行突變,這種突變是在自然界中可能可以發生的。
因此,基因編輯作物與含有外來基因的基因轉殖不同,可能可以解決基因改造作物所面臨的法規監管困境以及消費者的食安疑慮。但是大多數的作物基因編輯方法都是使用基因轉殖的方法,需要把相關所需要的編輯工具送到染色體中(形成基因轉殖植物),等基因編輯完成後,因為已不再需要基因編輯的工具,再以交配的方式把這些工具去除。但這個方式因為一開始仍需要基因轉殖,所以造成無法應用到一些很久才能開花的作物(如果樹),或是無法結種(如香蕉)的作物上。為了解決這樣的問題,我們實驗室與世界上其他的實驗室使用原生質體再生作為策略。結合 CRISPR/Cas 基因編輯技術及植物細胞可全能分化(totipotency)的特性,建立了多種植物不具有外源基因逢機插入(不需要形成基因轉殖植物)、並且可同時多基因、多目標序列發生編輯的細胞再生系統。相關的原理如下:
與動物細胞不同,植物細胞有細胞壁,所以要進行基因編輯時無法直接把工具送到細胞內。為了不阻擋 CRISPR/Cas 蛋白與引導 RNA 所形成的 RNP 基因編輯複合體(基因編輯工具)運輸到植物細胞中,我們將植物地上部器官(如葉片、莖、胚軸)的細胞壁用纖維酶與果膠酶分解並獲得原生質體細胞,讓 RNP 複合體可以順利穿過細胞膜孔隙,針對原生質體細胞中的目標基因序列發生剪切與編輯,接著基因編輯 RNP 複合體功成身退,隨即在細胞質中代謝分解。因為基因編輯工具不具有 DNA(只有蛋白質及 RNA),因此不存在逢機插入植物細胞染色體、產生基因改造的風險。
這些經過基因編輯的原生質體因脫離植物特定器官或組織區域的生理環境與細胞壁的束縛後,我們依據不同物種的原生質體發育特性,調配合適的生長調節劑與培養基營養條件,使原生質體表現出細胞全能性。如同花粉與胚株結合的受精卵一般,在 4 個月到 1 年之間,一顆不具有細胞壁的單一原生質體,重新生長出細胞壁,經過細胞分裂、分化產生胚狀體,進而發育出莖、葉與根部,再生成為一棵不具有外源 DNA 插入、且多個目標基因序列被編輯的植株。
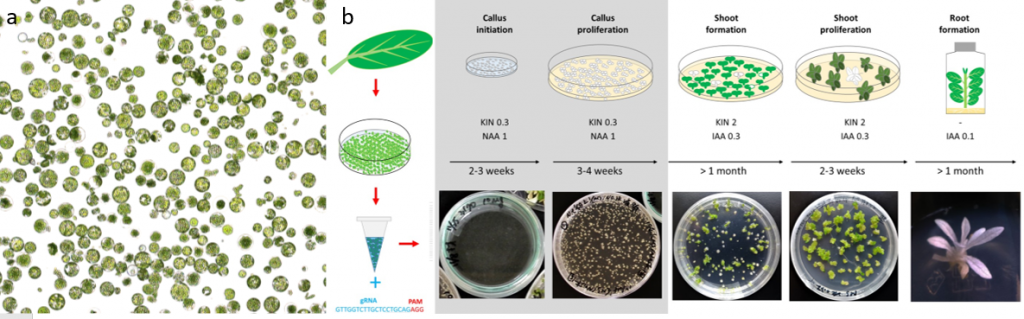
▲圖一、(a)葉肉細胞經纖維酶與果膠酶分解細胞壁後獲得游離的原生質體細胞。(b)從葉片分離出原生質體細胞後,將 RNP 複合體導入單一細胞發生基因編輯,因不同物種發育速度不同,在不同生長調節劑培養基培養 4-12 個月可再生為不具有外源基因導入染色體的基因編輯植株 3。
臺灣在組織培養的技術非常先進與發達。目前包括蘭花及香蕉的種苗皆是使用組織培養的技術生產。在這些基礎之下,我們實驗室於 2018 年利用菸草建立原生質體基因編輯與再生技術後,積極開發不同物種的原生質體細胞誘導與再生培養條件。至今已經成功將這個技術應用在阿拉伯芥、圓葉菸草 4與蕓薹屬模式植物;祕魯番茄(番茄重要抗病抗逆境育種親本)5;甘藍、青花菜、花椰菜(重要蔬菜作物);菸草、丹參及其他草藥等等。同時結合 CRISPR/Cas 基因編輯技術針對抗病基因、耐淹水基因、二級代謝物生合成基因獲得不具外源 DNA 插入的多基因編輯植株。這些基因編輯植株所缺失的 DNA 序列與傳統育種過程中所產生的遺傳多樣性相似,未來可持續應用在各物種分子育種上,所建立的技術操作參數,也可以成為親源相近物種的研究基礎。
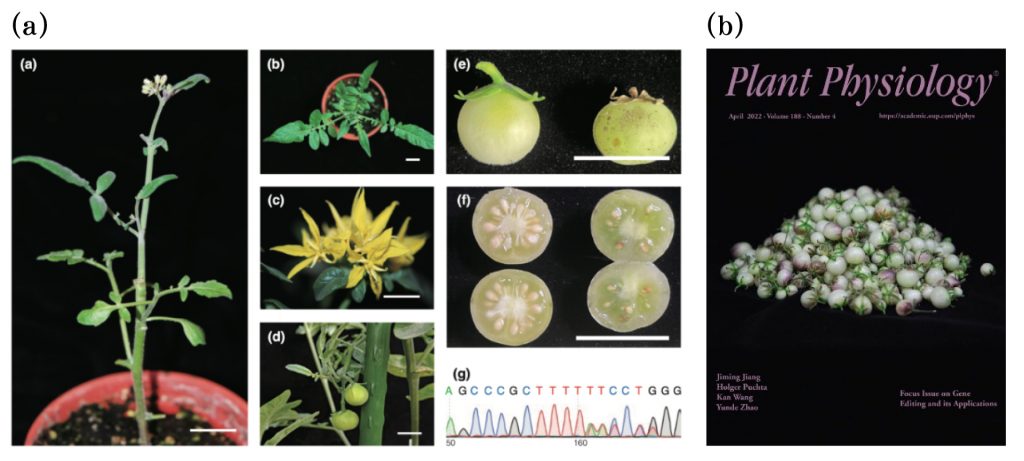
▲圖二、(a)利用原生質體再生及 RNP 技術進行秘魯番茄基因平台的建立,藉由抗病基因的編輯,以了解其抗病機制。
(b)相關的研究成果獲選為植物領域重要期刊《Plant Physiology》的封面。
1 Synthesis Report of The IPCC Sixth Assessment Report(AR6), https://report.ipcc.ch/ar6syr/pdf/IPCC_AR6_SYR_SPM.pdf
2 Jiang F, Doudna JA. CRISPR-Cas9 Structures and Mechanisms. Annu Rev Biophys. 2017 May 22;46:505-529. doi: 10.1146/annurev-biophys-062215-010822.
3 Lin CS, Hsu CT, Yang LH, Lee LY, Fu JY, Cheng QW, Wu FH, Hsiao HC, Zhang Y, Zhang R, Chang WJ, Yu CT, Wang W, Liao LJ, Gelvin SB, Shih MC. Application of protoplast technology to CRISPR/Cas9 mutagenesis: from single-cell mutation detection to mutant plant regeneration. Plant Biotechnol J. 2018 Jul;16(7):1295-1310. doi: 10.1111/pbi.12870.
4 Hsu CT, Yuan YH, Lin YC, Lin S, Cheng QW, Wu FH, Sheen J, Shih MC, Lin CS. Efficient and Economical Targeted Insertion in Plant Genomes via Protoplast Regeneration. CRISPR J. 2021 Oct;4(5):752-760. doi: 10.1089/crispr.2021.0045.
5 Lin CS, Hsu CT, Yuan YH, Zheng PX, Wu FH, Cheng QW, Wu YL, Wu TL, Lin S, Yue JJ, Cheng YH, Lin SI, Shih MC, Sheen J, Lin YC. DNA-free CRISPR-Cas9 gene editing of wild tetraploid tomato Solanum peruvianum using protoplast regeneration. Plant Physiol. 2022 Mar 28;188(4):1917-1930. doi: 10.1093/plphys/kiac022. PMID: 35088855; PMCID: PMC8968427.
