
病毒是什麼樣的存在?
病毒,是個大家耳熟能詳的微小病原體。我們暫且跳脫對其所造成傳染性疾病的恐懼來探究病毒本質上是什麼,它基本上就是一段有包裝的遺傳物質。那包裝可能是蛋白質殼,可能有脂質外膜,或殼膜兼備,總之包裹成一個奈米顆粒。外殼或膜不但保護內部的遺傳物質,也協助病毒遺傳物質進入宿主細胞內。而其內含的遺傳物質可能是 DNA、或是同樣可傳遞遺傳訊息的 RNA,總之病毒的任務就是把自己的 DNA 或 RNA 送到宿主細胞中,致使宿主細胞依照病毒送來的指示生產更多新生的病毒。
病毒不一定要讓宿主(我們)生病,但若在複製病毒過程中、或宿主抗拒時造成宿主生病了,只要不影響病毒複製,對病毒來說皆無妨。病毒顆粒裡包裹的遺傳物質若是 DNA,那麽複製過程中病毒 DNA 會先被轉錄成 RNA 再轉譯為病毒複製或組裝所需的蛋白質。另有很多病毒是直接包裹 RNA 的,那麼病毒 RNA 也可以被轉譯為蛋白質。總之病毒在複製過程中一定有個步驟會需要用到 RNA。因此, RNA 不只是分子生物學的資訊傳遞鏈中(DNA → RNA →蛋白質)的中堅份子,也是病毒複製過程中所必須使用到的分子種類。
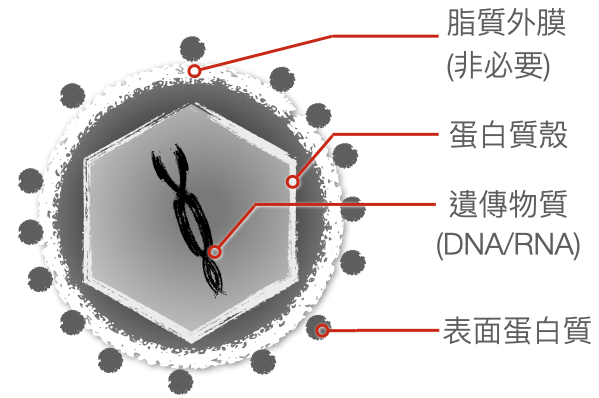
▲病毒顆粒的基本結構(不同病毒結構會有些許不同)。
遺傳物質 RNA 序列上的額外化學修飾
基礎生物學中普遍對 RNA 的介紹是:生物的基因記錄於 DNA 之中,而這些基因要表現、使其有功能,會需要先從 DNA 把訊息抄寫(轉錄)為 RNA,RNA 上的訊息再被轉譯為有功能的蛋白質。如果我們把這過程比喻為一個廚師在做菜,那廚師先看的食譜是 DNA,用來抄寫筆記的便條紙即為 RNA,而依照便條紙做出來的料理就是「有功能的蛋白質」。
長久以來,生物學界一直認為承載著基因序列的遺傳物質,不管是 A、T、C、G 四個鹼基組合而成的 DNA,還是 A、U、C、G 組成的 RNA 都是只用四個鹼基的排列組合就可以記錄、傳遞生命延續與運作所需的資訊了。不過近幾年來,人們逐漸瞭解到 DNA 並非全部一定會被讀到,而是不同區段會被額外標記此段是否需要被解讀與使用。這些額外的標記,例如:在 DNA 上加上甲基(CH3, methylation)修飾,對 DNA 被解讀與否的調控,即成為了「表觀遺傳學(epigenetics)」這個新興學門。同樣的,RNA 也可以被修飾,進而調控 RNA 之功能、轉譯、與存在時間,此稱為「表觀轉錄體學(epitranscriptomics)」。
早期發現的病毒 RNA 修飾
因為病毒小,它們的基因體序列比大部分生物的短很多,因此在處理長序列的技術相對少,研究早期,病毒成為很多分子生物學「相對簡單」的研究主題。以 RNA 修飾來說,早在 1975 年 Lavi & Shatkin 即發現猿猴病毒 40(SV40)的 RNA 在 A 的鹼基上(腺苷)有甲基化修飾(N6-methyladenosine, m6A)。緊接著在 1976 到 1977 年間 A 型流感病毒(Influenza A virus)、腺病毒(Adenovirus)、勞斯肉瘤病毒(Rous sarcoma virus)的 RNA 皆被發現有甲基化修飾的現象。不過礙於技術的限制,病毒學界長期無法破解病毒 RNA 修飾的功能為何。
病毒 RNA 修飾可增強病毒的基因表現
直到近期新技術的開發與 RNA 修飾酵素的發現,致使病毒 RNA 修飾的研究再度活絡了起來,逐步揭開病毒 RNA 修飾的神秘面紗。從 2016 年,三個實驗室同時發現人類免疫缺乏病毒(HIV-1)的 RNA 也有 m6A 甲基化修飾開始,RNA 修飾逐漸被發現並精準定位於多種病毒的 RNA 上,例如:日本腦炎病毒、B 型肝炎病毒、C 型肝炎病毒、呼吸道融合病毒(Respiratory syncytial virus, RSV)、以及各種冠狀病毒等,皆相繼被發現其 RNA 上有甲基化修飾。有趣的是,大部分病毒的 RNA 都是需要被修飾的,只要去除了 RNA 修飾,很多病毒的複製效率皆會顯著下降。
RNA 甲基化修飾促進病毒複製的現象,在 HIV-1 和腺病毒中尤其明確,有修飾的 HIV-1 RNA 可以在宿主細胞中存活比較久,避免病毒 RNA 在完成任務前先被宿主細胞裂解;此外 RNA 可以在生產出來後再被剪接(RNA splicing),不同的剪接方式表現出不同的蛋白質,而 RNA 甲基化可以調控 RNA 的剪接,以確保 HIV-1 和腺病毒表現的病毒蛋白質種類正確、或各種類表現比例合乎病毒當下的需求。
RNA 修飾可調控細胞的抗病毒免疫
除了調控病毒基因的表現,RNA 修飾也可以調控宿主細胞的抗病毒反應。人類巨細胞病毒(Human Cytomegalovirus, HCMV)是個不常聽到,但可造成新生兒聽力嚴重受損的常見病毒。雖然人類巨細胞病毒的 RNA 上找不到甲基化修飾,但這病毒可以增強宿主細胞內的 RNA 甲基化機制,使細胞內的重要抗病毒基因干擾素 β(interferon β)的 RNA 被甲基化。有趣的是宿主細胞的 RNA 被甲基化反而可以促進其裂解,致使這病毒感染過程中,倚賴干擾素 β 的抗病毒機制被削弱,使病毒能夠更有效率的複製。
2005 年 Kariko & Weissman 發現人工合成的 RNA 若直接送進細胞裡,會誘發產生嚴重的免疫反應而造成細胞死亡,若加入甲基化修飾則可以避免人工 RNA 被細胞偵測為外來物產生免疫反應,在各種修飾中以甲基化假尿嘧啶核苷(N1-methylpseudouridine, m1ψ)的效果最好。此發現使人們理解到加入甲基化修飾即可去除人工合成 RNA 對細胞的毒性,而應用此技術的 RNA 疫苗成為了全世界 COVID-19 肺炎疫情的解方,因此今年(2023)Kariko & Weissman 獲頒了諾貝爾醫學獎。
既然 RNA 修飾可以防止「外來」RNA 被細胞發現、觸動免疫反應,那麼病毒是否也會使用這個方法偷偷的混進細胞呢?的確近年來多種包裹 RNA 的病毒皆被發現採用這種方式避免觸動宿主細胞的抗病毒免疫反應,包含人類間質肺炎病毒(Human metapneumovirus, HMPV)、呼吸道融合病毒(Respiratory syncytial virus, RSV)、新冠肺炎病毒(SARSCoV-2)皆被發現其病毒 RNA 上的甲基化修飾可以減少病毒 RNA 觸動細胞偵測機制,進而減少抗病毒物質干擾素的產生。
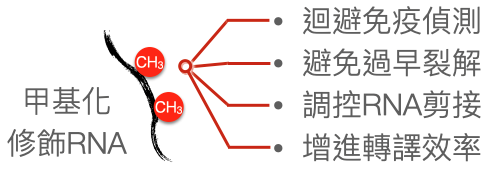
▲病毒 RNA 甲基化修飾的多樣功能
未來展望與病毒 RNA 修飾的應用
綜合以上研究,多數病毒挪用了 RNA 修飾這個細胞的基因調控機制,來促進病毒感染成功率、基因表現、和複製效率。因為 RNA 修飾對多樣化的病毒複製有重要的促進效果,因此我們認為有望針對這個機制來研發新的抗病毒藥物。近幾年來有大量研究發現 RNA 修飾也在癌細胞發展的過程中佔有重要角色,因此已有多個新創公司正在開發可抑制 RNA 甲基化修飾的新藥以作為抗癌藥。有趣的是,其中最早發表的 RNA 甲基化抑制劑,在 2021 年被英國新創公司「風暴製藥(Storm Theraputics)」以抗白血病藥(acute myeloid leukemia, AML)的名義發表於期刊以後,也緊接的被紐約大學團隊發現在培養皿中可以抑制新冠肺炎病毒和小感冒冠狀病毒(HCoVOC43)的複製。
雖然這些技術還在開發階段,劑量與安全性需進一步測試與評估的新藥,但相信未來會有越來越多 RNA 修飾抑制劑被開發出來,屆時也會更加了解是否這類藥物可用為抑制多種病毒複製的廣效性抗病毒藥。COVID-19 疫情再次顯示,每隔幾年就會有未知的新興傳染疾病進入人群,而且人類並不是每次都會像 SARS 疫情那樣幸運的可以等它自然消失。因此人們需要儲備多種廣效性抗病毒藥,以備快速對抗未來出現的新病毒所需,而我們認為 RNA 修飾是一個可望滿足此需求的抗病毒標的機制。
延伸閱讀
Tsai K, Cullen BR. Epigenetic and epitranscriptomic regulation of viral replication. Nat Rev Microbiol. 2020 Oct;18(10):559-570. doi: 10.1038/s41579-020-0382-3. Epub 2020 Jun 12. PMID: 32533130; PMCID: PMC7291935.
Courtney DG. Post-Transcriptional Regulation of Viral RNA through Epitranscriptional Modification. Cells. 2021 May 7;10(5):1129. doi: 10.3390/cells10051129. PMID: 34066974; PMCID: PMC8151693.
Nance KD, Meier JL. Modifications in an Emergency: The Role of N1-Methylpseudouridine in COVID-19 Vaccines. ACS Cent Sci. 2021 May 26;7(5):748-756. doi: 10.1021/acscentsci.1c00197. Epub 2021 Apr 6. PMID: 34075344; PMCID: PMC8043204.
