
細胞為生命體的最小生物單位。細胞內持續地透過各式不同的化學反應產生適當的生化產物,用以維持細胞的活動。科學家早期利用顯微鏡發現細胞內有不同的胞器,並且這些由脂質所包圍的胞器能夠分隔出各自獨立的空間,讓執行特定反應的相關生物分子(例如:蛋白質)能夠共同群聚在一定的範圍內,使得特定的化學反應便能發生在適當的時間與地點,並進一步提高其反應效率。例如,粒線體通過雙層膜結構將不同蛋白質間隔在不同的區域,實現專一且高效的呼吸作用,生成能量。
然而,科學家近年來發現細胞內許多從事特定反應的相關生物分子能夠群聚在一起,但並不需要細胞膜的存在。這現象主要藉由生物分子(例如:蛋白質)之物理與化學特性產生液體與液體之相分離(Liquid-liquid phase separation),使特定的生物分子能夠從細胞質中成千上萬的其它分子中分離並且聚集,形成高濃度的液滴狀之生物分子聚集體(圖一 A)1。
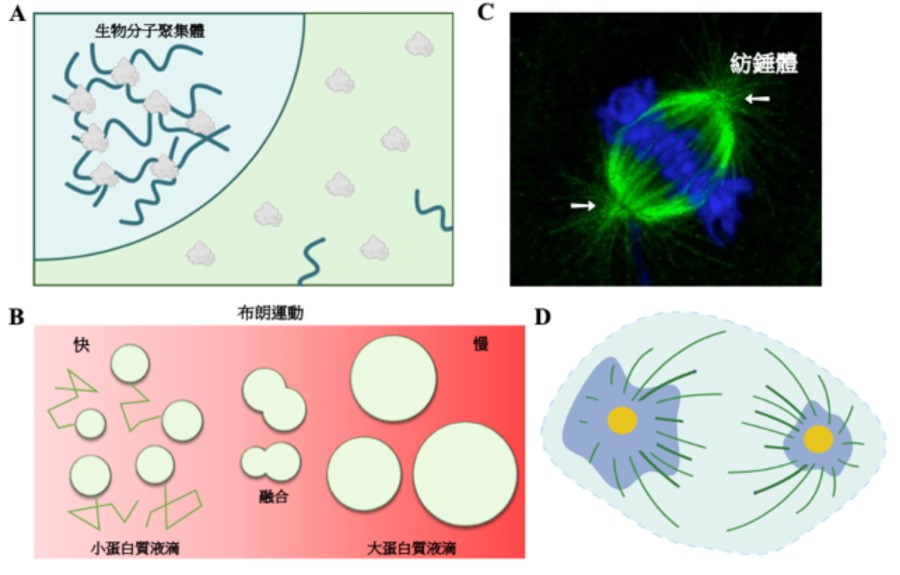
▲圖一:蛋白質的相分離
A. 蛋白質透過物理及化學交互作用產生生物分子聚集體。B. 小蛋白質分子聚集行較快速布朗運動碰撞融合成大蛋白質液滴並伴隨其布朗運動能力降低。C. 細胞分裂時紡錘體(白色箭頭)被大量微管包圍(綠色:微管;藍色:染色體)。D. 果蠅胚胎細胞中發現當不對稱細胞分裂進行時,兩端的中心粒周圍物質有大小的差異(藍色:中心粒周圍物質;黃色:中心粒)。
由於這些生物分子在聚集體中往往都共同執行特定之生物功能,依此特性將這些聚集體通稱為無膜胞器。一般來說,這些通過相分離現象形成的生物分子聚集體會在細胞內通過布朗運動自由地流動。由於其高動態之特性,當生物分子聚集體相互碰撞時,它們能夠互相融合並形成更大體積之聚集體。同時,也會隨之降低其布朗運動之能力(圖一 B)。
目前多種的無膜胞器已經於細胞核與細胞質中被發現,並扮演不同且重要的生物功能,例如:細胞質中處理小體(P-bodies),細胞核內的應激顆粒(Stress granules)與神經元樹突棘中的生物分子聚集體 2。其中,負責細胞內細胞骨架之微管(microtubule)生合成,被稱為微管組織中心的中心體(centrosome)便是藉由相分離現象調控其複製與成熟的無膜胞器之一。中心體的內部由一群結構蛋白質組成中心粒(centrioles),其外圍則由許多無定形蛋白質所包圍,形成中心粒周圍物質(pericentriolar material, PCM)。
當細胞將進行細胞分裂時,蛋白質會聚集至中心體之周圍物質區,使得其體積增大,從而促進微管之生合成以利紡錘體的形成(圖一 C)3。由於中心體不具備細胞膜,但卻能讓相關蛋白質聚集以執行特定之生物功能,因此中心體也被歸類於無膜胞器之一員。然而,中心體相對於其它無膜胞器卻具有許多獨一無二之生物特徵。
首先,中心體之數目是受嚴格控制的。在正常的細胞內,細胞間期中固定只有一個中心體,在細胞分裂時會複製形成兩個中心體。然而其它無膜胞器則有數十到數百個並分布在細胞中;第二,中心體之體積是受嚴格調控的。在細胞增殖時,中心體位於對稱細胞分裂之紡錘體兩端的體積相同。然而,在細胞進行分化時,中心體位於非對稱細胞分裂之紡錘體兩端的體積卻不相同。最後,中心體由於也是微管組織中心,因此不論在細胞間期或分裂期,中心體會被許多微管所包圍(圖一 D)。
而在細胞分裂階段,大量的蛋白質「聚集」到中心體,造成其體積擴張並使其成熟,以利執行相關之生物功能 4。然而,領域內對於中心體這個無膜胞器如何「聚集」特定之蛋白質的分子機制、中心體數量與體積如何維持的調控機制都並沒有定論。目前認為是藉由被動擴散作用和布朗運動使相分離的中心體蛋白質產生聚集的現象。但是僅藉由這兩種物理現象,是否足夠調控中心體數量與體積,以及是否還有其他機制牽涉其中都尚未揭示。
筆者實驗室的研究主題之一,即探討微管在中心體擴張與成熟中所扮演的角色。在過去的研究文獻中,有研究團隊證明了中心體中的支架蛋白(Scaffolding protein)會與紡錘體上的驅動蛋白(Kinesin)相互作用,從而連接了中心體與紡錘體,並確保紡錘體結構上的完整性(圖二 A)5。
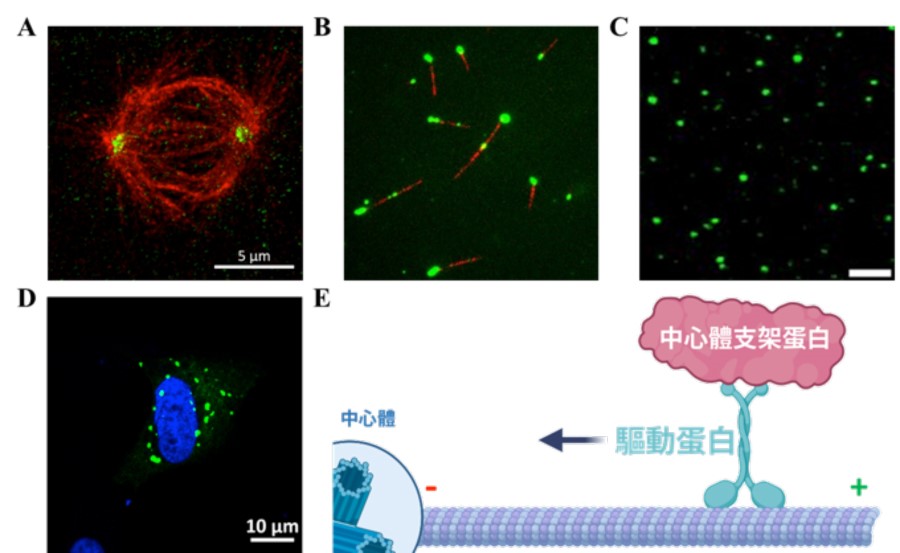
▲圖二:中心體支架蛋白與驅動蛋白的交互作用
A. 經由免疫染色的海拉細胞透過超高解析顯微鏡拍攝結果(紅色:驅動蛋白;綠色:中心體支架蛋白)。B. 驅動蛋白主動運輸支架蛋白到微管的一端(紅色:微管;綠色:中心體支架蛋白)C. 中心體支架蛋白(綠色)形成蛋白質液滴。D. 大量表現中心體支架蛋白在海拉細胞中會形成蛋白質聚集體(綠色:中心體支架蛋白;藍色:染色體)。E. 理論模型示意圖
以此研究為構想基礎,筆者之實驗室利用基因剔除技術(Knockdown)降低細胞內其中一種驅動蛋白的蛋白量。通過顯微鏡觀察進一步發現,在細胞分裂過程中,支架蛋白在中心體上數量也相對的減少。這個結果指出驅動蛋白的存在與中心體中支架蛋白數量的關聯性。由於驅動蛋白能夠在微管上攜帶貨物蛋白(Cargo proteins)往目的地做移動,因此本研究團隊提出了微管依賴性的主動運輸可能在中心體中蛋白質的聚集扮演了重要的角色。
為了進一步探究驅動蛋白主動運輸中心體支架蛋白的分子機制,研究團隊純化高純度的重組蛋白,並利用全內角反射螢光顯微鏡觀察發現,當有提供能量(ATP)情況下,驅動蛋白能夠促使帶有螢光標定之支架蛋白聚集在微管的負端(在分裂細胞中,微管負端多位於紡錘體兩極,並匯聚於中心體之周圍)(圖二 B)。值得注意的是,之前的文獻中並未提及這驅動蛋白可以在微管上進行長距離且有方向性的移動。因此,這個發現也同時揭示了中心體支架蛋白能夠調控驅動蛋白的運輸活性。
因此,本研究發現當驅動蛋白與中心體支架蛋白作用時,會促使驅動蛋白持續地進行運動,將支架蛋白向微管的負端移動的現象。進一步發現中心體支架蛋白會以聚集體的形式由驅動蛋白來運輸。在這過程中,聚集體會發生進一步聚集的現象,最後堆積於微管的負端。
這觀察顯示了此聚集體與之前提到相分離現象有高度的相似性。值得注意的是,由於生物分子聚集體的高動態特性,當生物分子聚集體互相融合並形成更大體積之聚集體,理論上也會隨之降低其布朗運動之能力與被動運輸之速率。然而,中心體支架蛋白聚集體的運輸速率並不會隨著聚集體的大小發生改變,此特性有利於相對短時間內中心體擴張與成熟的需要。
線蟲的中心體支架蛋白已經被證明能夠聚集成液滴狀之生物分子聚集體 6。為了能夠了解人類的中心體支架蛋白是否具有相同的蛋白特性。研究團隊使用顯微鏡觀察高純度之螢光標定中心體支架蛋白,發現此蛋白質同樣也能形成液滴,並且驅動蛋白也會溶入這此液滴中(圖二 C)。有趣的是,當驅動蛋白進入中心體支架蛋白的液滴,會使得液滴的材料特性變得更加通透且高動態。為了驗證在試管中觀察到的結果,研究團隊進一步利用在細胞中大量表達螢光標定的支架蛋白,觀察到支架蛋白的確會在細胞中形成蛋白質液滴,而驅動蛋白的存在能夠提高其活性(圖二 D)。
細胞內不斷發生著化學反應,以維持生命活動。為了精確調控複雜的生化反應,細胞必須創造獨立的環境來促進各種反應的進行,包括被磷脂雙層膜包圍的胞器,和透過相分離現象形成的無膜胞器。中心體在細胞間期與細胞分裂過程中扮演了重要的角色,雖然學界對於中心體的功能(例如:調控微管的生成)有一定的了解,但對中心體如何以相分離的特性複製與擴張所知卻有限。
本實驗室特別專注於探究細胞骨架微管在無膜胞器中心體擴張中的功能,並提出圍繞於中心體的微管在調節中心體的成熟過程中發揮著關鍵作用之理論,說明中心體蛋白質的聚集除了利用被動擴散作用外,微管與驅動蛋白也扮演著重要的角色(圖二 E)。
- Banani, S., Lee, H., Hyman, A. et al. Biomolecular condensates: organizers of cellular biochemistry. Nat Rev Mol Cell Biol 18, 285–298 (2017).
- Shin Y, Brangwynne CP. Liquid phase condensation in cell physiology and disease. Science. 2017 Sep 22;357(6357)
- Conduit PT, Brunk K, Dobbelaere J, Dix CI, Lucas EP, Raff JW. Centrioles regulate centrosome size by controlling the rate of Cnn incorporation into the PCM. Curr Biol. 2010 Dec 21;20(24):2178-86.
- Conduit, P., Wainman, A. & Raff, J. Centrosome function and assembly in animal cells. Nat Rev Mol Cell Biol 16, 611–624 (2015).
- Chavali, P., Chandrasekaran, G., Barr, A. et al. A CEP215–HSET complex links centrosomes with spindle poles and drives
centrosome clustering in cancer. Nat Commun 7, 11005 (2016). - Woodruff JB, Ferreira Gomes B, Widlund PO, Mahamid J, Honigmann A, Hyman AA. The Centrosome Is a Selective Condensate
that Nucleates Microtubules by Concentrating Tubulin. Cell. 2017 Jun 1;169(6):1066-1077.e10.
